Solid organ transplantation is often life-saving. Transplanting a different genetic graft determines the immune response of the recipient, which detects the graft as a non-self, and tries to eliminate it. Immunosuppressive therapy is essential to prevent allograft rejection. Immunosuppression begins with induction therapy, followed by maintenance therapy. If hyperacute or acute rejections occur, they are reversed with certain immunosuppressive intensive care regimens. Immunosuppression is realized with glucocorticosteroids and other drugs that diminish T lymphocytes response or interfere with other stages of the immune response to the graft. Marked toxicity of individual immunosuppressants, as well as the risks associated with immunosuppression make it imperious to use minimal effective doses of immunosuppressants to maintain graft maintenance. Therefore, synergic drug combinations are commonly used, which allow for the smaller doses of each drug. Immunosuppressants are frequently involved in drug interactions and drug-food interactions, making treatment surveillance more challenging.
Terapia imunosupresivă după transplantul de organ solid
Immunosuppressive therapy after solid organ transplantation
First published: 29 octombrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.184.5.2018.2009
Abstract
Rezumat
Transplantul de organe solide este adesea salvator de viaţă. Transplantarea unei grefe diferite genetic de organismul transplantatului determină răspunsul imun al acestuia, care, detectând grefa ca fiind non-self, încearcă să o elimine. Terapia imunosupresoare este esenţială pentru împiedicarea rejetului alogrefei. Imunosupresia se începe cu terapie de inducţie, urmată de terapie de menţinere. Dacă apare rejet hiperacut sau acut de grefă, acesta se reversează cu anumite scheme de terapie imunosupresivă intensă. Imunosupresia se face cu glucocorticosteroizi şi alte medicamente care depletesc limfocitele T sau intervin în alte etape ale răspunsului imun la grefă. Toxicitatea marcată a imunosupresoarelor individuale, ca şi riscurile asociate imunosupresiei fac imperioasă folosirea dozelor minime eficace de imunosupresoare care să asigure menţinerea grefei. De aceea, se folosesc frecvent asocieri sinergice de medicamente, care permit utilizarea de doze mai mici din fiecare medicament în parte. Imunosupresoarele sunt frecvent implicate în interacţiuni medicamentoase sau în interacţiuni medicament-aliment, ceea ce face supravegherea terapeutică cu atât mai solicitantă.
Transplantul de organ solid este salvator de viaţă pentru pacienţii care suferă de insuficienţe severe cardiace, hepatice sau pulmonare. Pacienţii cu insuficienţă renală severă nu mai au nevoie de dializă după transplant. Această lucrare se referă la terapia imunosupresoare după transplant de organe (părţi sau întregi) şi ţesuturi.
Tipuri de transplant
Grefele transplantate unui pacient pot fi:
-
autogrefe – provin de la pacient;
-
izogrefe – provin de la un donator identic genetic (geamăn homozigot);
-
alogrefe – provin de la un donator genetic asemănător (de la un alt om);
-
xenogrefe – provin de la o specie diferită (se folosesc rar)(1).
Materialul transplantat poate fi:
-
celule (de exemplu, transplant de celule stem hematopoietice);
-
părţi sau segmente de organ (de exemplu, lobi hepatici sau pulmonari, grefe de piele);
-
organe întregi (inimă, rinichi);
-
ţesuturi (de exemplu, cornee)(1).
Pentru ca grefa să nu fie respinsă de sistemul imunitar al organismului care o primeşte, este de dorit să existe un grad cât mai mare de histocompatibilitate între donator şi primitor. Cu cât suprapunerea e mai mare, cu atât intensitatea terapiei imunosupresoare care previne rejetul grefei e mai mică(2).
Histocompatibilitate. Noţiuni de imunologie
Histocompatibilitatea reprezintă procesul prin care gene polimorfe codifică antigenele prezente pe membrana celulară care servesc drept ţinte ale sistemului imunitar, chiar şi în cadrul unei specii(3).
După transplantare, organismul detectează grefa ca fiind străină şi declanşează răspunsul imun de respingere. Principala ţintă a sistemului imunitar este complexul major de histocompatibilitate (MHC; Major Histocompatibility Complex). MHC uman este cunoscut şi drept HLA (Human Leukocyte Antigen). HLA este un set de glicoproteine exprimate la suprafaţa celor mai multe celule. Aceste proteine sunt implicate în recunoaşterea şi discriminarea self/non-self şi sunt principalii determinanţi antigenici de respingere a alogrefei(3).
Există două clase majore de HLA:
- clasa I: exprimate la suprafaţa tuturor celulelor nucleate; sunt recunoscute de celule CD8+ (limfocitele T citotoxice). Are trei subclase: HLA-A, HLA-B, şi HLA-C.
- clasa a II-a: exprimată exclusiv la suprafaţa celulelor prezentatoare de antigeni care au rolul de a stimula celulele CD4+ (limfocitele T helper). Are trei subclase: HLA-DP, HLA-DQ şi HLA-DR(3).
Limfocitele T joacă un rol major în răspunsul imun mediat celular.
Limfocitele T citotoxice (CD8+) sunt implicate în distrugerea celulelor-ţintă prin activarea apoptozei sau prin eliberarea unor compuşi citotoxici(3).
Limfocitele T helper (CD4+) controlează activitatea întregului sistem imunitar, transmiţând informaţii care determină activarea sau suprimarea răspunsului. Unele celule T helper secretă citokine care recrutează limfocite T citotoxice, limfocite B sau celulele prezentatoare de antigen, în timp ce altele secretă citokine care suprimă răspunsul imun(3).
Limfocitele T reglatoare (celulele T supresoare) suprimă răspunsul imun(3).
Limfocitele B joacă un rol important în răspunsul imun mediat umoral. Când limfocitele B întâlnesc un antigen şi primesc un semnal stimulator de limfocitele T helper, ele se pot diferenţia în plasmocite sau în limfocite B cu memorie. Plasmocitele secretă anticorpi care determină distrugerea antigenilor prin recrutarea complementului şi/sau opsonizare. Limfocitele B cu memorie asigură imunitatea pe termen lung, fiind capabile să răspundă rapid la expuneri ulterioare la antigenul lor ţintă(3).
O celulă prezentatoare de antigen este o celulă care are fixată la suprafaţa ei un antigen străin complexat cu MHC, antigen pe care îl prezintă limfocitelor T.
Imunobiologia rejetului acut de grefă. Mecanismele de acţiune ale medicamentelor imunosupresoare
Respingerea organului transplantat este un proces cu mai multe etape, care cuprinde recunoaşterea aloantigenului, activarea limfocitelor, multiplicarea limfocitelor şi inflamaţia grefei.
Recunoaşterea antigenilor prezenţi în organul transplantat (aloantigeni) este evenimentul principal care iniţiază răspunsul imun împotriva alogrefei.
Recunoaşterea aloantigenului necesită prezentarea de către o celulă prezentatoare de antigeni a unui aloantigen străin, complexat cu o moleculă a MHC. Antigenul, legat de o moleculă HMC, se leagă de receptorii limfocitelor T. La acest nivel acţionează imunoglobulinele antilimfocit.
Activarea limfocitelor T se face în urma costimulării, un proces în care liganzi de pe celulele prezentatoare de antigeni se leagă de receptori ai celulor T (CD28, CD154, CD2, CD11a şi CD54).
Activarea celulelor T de către o celulă prezentatoare de antigeni necesită implicarea receptorului limfocitelor T prin complexul CMH-antigen (semnalul 1) şi legarea moleculelor costimulatoare (CD80, CD86) de pe celula dendritică la CD28 de pe limfocitul T (semnalul 2)(2).
Compuşii rezultaţi sunt internalizaţi şi se leagă de imunofiline. Imunofilinele stimulează calcineurina, care activează factorul nuclear de activare a limfocitelor T (NFAT). Acest factor NFAT activat intră în nucleul limfocitelor şi determină transcrierea de interleukină 2 (IL-2). Două ţinte ale imunofilinei, ciclofilina şi FK-binding protein, sunt ţinte ale ciclosporinei, respectiv tacrolimusului. După legare de aceste situsuri, ciclosporina şi tacrolimusul blochează efectele calcineurinei, aceste medicamente fiind numite inhibitori de calcineurină(2).
Multiplicarea limfocitelor T (expansiunea clonală). IL-2 nou sintetizată este secretată de limfocitele T activate anterior şi se leagă apoi de receptorii IL-2 (IL-2R) pe suprafaţa acestor limfocite într-un mod autocrin, stimulând proliferarea celulară masivă a acestora. Anticorpii monoclonali basiliximab şi daclizumab blochează legarea IL-2 de receptorii ei. Sirolimus şi everolimus se leagă de mToR (mammalian target of rapamycin sau mechanistic target of rapamycin); împiedică şi ei multiplicarea limficitelor T. Azatioprina şi micofenolatul de mofetil inhibă sinteza bazelor purinice, inhibând astfel sinteza de ADN şi împiedicând expansiunea limfocitelor T(2).
Inflamaţia. Proliferarea celulelor T este asociată cu citotoxicitatea mediată celular şi secreţia de citokine, chemokine şi molecule de adeziune. La nivelul grefei sunt recrutate şi mai multe celule inflamatorii, care pot antrena în cele din urmă disfuncţii majore ale grefei, cu distrugerea ei. La acest nivel se poate interveni cu glucocorticoizi şi imunoglobuline antilimfocite(3).
Rejetul de grefă
Există patru tipuri de rejet de grefă care pot apărea după transplant de organ.
Rejetul hiperacut
Apare la câteva ore după operaţia de transplant şi nu poate fi stopat de medicaţia imunosupresivă. Se datorează anticorpilor preformaţi din organismul primitor, anticorpi împotriva a ceea ce e recunoscut drept antigen din grefă (de exemplu, incompatibilitate între grupele sangvine). Rejetul hiperacut se manifestă rapid cu necroză şi conduce la compromiterea grefei(2).
Rejetul accelerat
Anticorpii şi limfocitele T sunt implicate. Nu poate fi stopat de medicaţia imunosupresivă(2).
Rejetul acut
Apare în primele luni după transplant, datorându‑se imunităţii celulare (sunt implicate limfocitele T). Rejetul acut poate fi reversat cu medicaţie imunosupresivă (azatioprină, micofenolat mofetil, ciclosporină, tacrolimus, glucocorticoizi, ciclofosfamidă, metotrexat, sirolimus etc.)(2).
Rejetul cronic
Apare la luni sau ani după transplant. Sunt implicate atât imunitatea celulară, cât şi imunitatea umorală. Pentru prevenirea rejetului cronic se folosesc aceleaşi medicamente ca la rejetul acut. Odată declanşat, rejetul cronic nu poate fi reversat cu medicamentele disponibile actual(4).
Boala grefă-contra-gazdă
Limfocitele T de la nivelul grefei recunosc ca non-self organe ale transplantatului (de obicei, pielea, ficatul sau intestinul) şi le atacă; consecutiv, apar rash-ul, diareea severă şi hepatotoxicitate. Medicaţia imunosupresivă folosită diminuează şi aceste manifestări, totuşi ele pot apărea şi se pot croniciza; în această situaţie, imunosupresia se face pe perioade lungi, uneori toată viaţa(2).
Clasificarea medicamentelor imunosupresoare folosite posttransplant
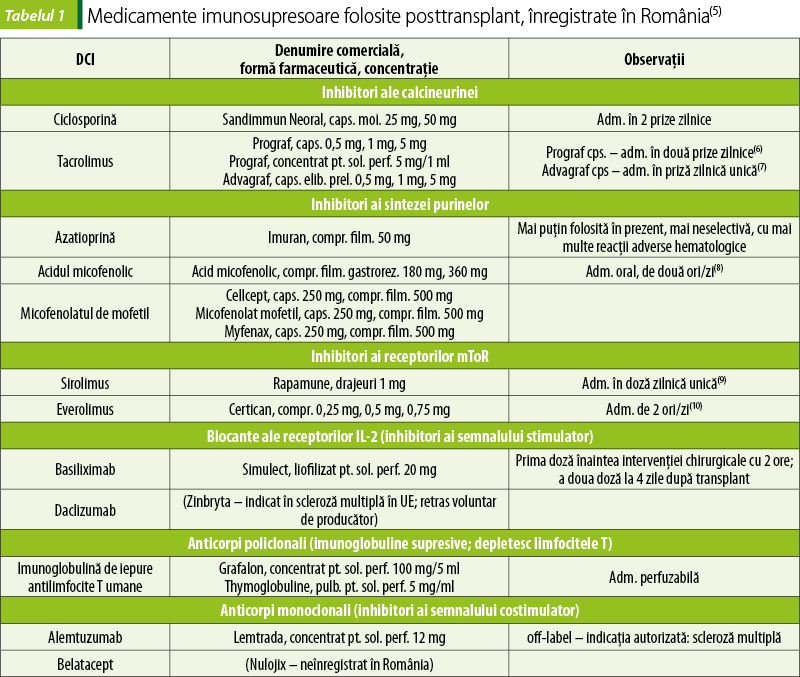
Glucocorticosteroizi
Corticosteroizii blochează activarea citokinelor, inhibând astfel IL-1, IL-2, IL-3, IL-6, interferonul g şi sinteza factorului de necroză tumorală-a. În plus, corticosteroizii interferează cu migraţia celulară, recunoaşterea antigenelor şi efectul citotoxic al limfocitelor(4). Glucocorticosteroizii au proprietăţi limfolitice. Ei reduc dimensiunea şi conţinutul limfoid ale ganglionilor limfatici şi ale splinei. Interferează cu ciclul celular al celulelor limfoide activate. Imunitatea celulară este mai afectată decât imunitatea umorală, totuşi, la administrare repetată, şi activitatea anticorpilor este diminuată(2).

Mecanisme
Reacţiile adverse ale dozelor mari de corticosteroizi folosite în terapia posttransplant includ:
-
la nivel cardiovascular – hiperlipidemie, hipertensiune;
-
la nivel SNC – anxietate, insomnie, tulburări de dispoziţie, psihoze;
-
reacţii adverse dermatologice – acnee, diaforeză, echimoze, hirsutism, întârzierea vindecării rănilor, peteşii;
-
la nivel endocrin şi metabolic – sindrom Cushing, hiperglicemie, retenţie hidrosalină;
-
la nivel gastrointestinal – gastrite, creşterea apetitului, creştere ponderală, greaţă, vărsături, diaree, ulcere peptice;
-
reacţii adverse hematologice – leucocitoză;
-
la nivel neuromuscular şi scheletic – artralgii, întârzierea creşterii la copii, osteoporoză, slăbiciune musculară;
-
la nivel ocular – glaucom, cataractă(3).
Inhibitori de calcineurină
Inhibitorii de calcineurină blochează proliferarea limfocitelor T prin inhibarea producţiei de IL-2 şi a altor citokine de către aceste celule. Ciclosporina şi temsirolimusul se leagă de imunofiline, inhibând astfel acţiunea calcineurinei de stimulare a transcripţiei unor citokine esenţiale pentru funcţionarea limfocitelor T, cum ar fi IL-2(4).
Biodisponibilitatea orală variabilă, metabolizarea extinsă prin intermediul citocromului P450 CYP3A4 cu multiple interacţiuni medicamentoase şi reacţiile adverse severe fac necesară monitorizarea atentă a acestor medicamente, prin dozarea concentraţiilor plasmatice la intervale de timp bine definite.
Inductorii citocromului P450 CYP3A4 pot spori metabolizarea acestora, cu scăderea concentraţiilor plasmatice şi risc de ineficacitate terapeutică, adică creşterea şanselor de rejet de grefă, iar inhibitorii citocromului P450 CYP3A4 le pot împiedica metabolizarea, cu creşterea concentraţiilor plasmatice şi risc de supradozare şi favorizare a reacţiilor adverse grave. Farmacistul poate face parte din echipa de supraveghere terapeutică a medicaţiei posttransplant şi se poate implica în optimizarea acesteia prin detectarea interacţiunilor medicamentoase şi prin alte activităţi.
Ciclosporina
Ciclosporina se leagă de imunofilina ciclofilină. Ciclosporina este înalt lipofilă, dar are o biodisponibilitate orală variabilă (între 5% şi 60%), cu o medie de 30%; variabilitatea se datorează, printre altele, dependenţei absorbţiei de cantitatea de bilă, care este variabilă între indivizi şi care poate să se modifice după intervenţii chirurgicale pe tractul digestiv.
Produsele medicamentoase cu varianta microemulsionată a ciclosporinei sunt mai puţin afectate de variabilitatea absorbţiei; formele farmaceutice conţinând ciclosporină microemulsionată şi ciclosporină standard nu sunt bioechivalente. Ciclosporina circulă în sânge legată de proteinele plasmatice (lipoproteine), în procent de peste 90%. Distribuţia în ţesuturi este largă. Metabolizarea se face extensiv de către citocromul P450 CYP3A4, în ficat şi intestin, cu numeroase interacţiuni medicamentoase(2).
Tacrolimus
Tacrolimus se leagă de imunofilina FK-binding protein-12 (FKBP12).
Şi tacrolimusul este foarte lipofil şi are o biodisponibilitate orală variabilă (între 4% şi 93%, cu o medie de 20%). Circulă în sânge legat de albumină şi a1-acid glicoproteină. Tacrolimusul se distribuie predominant în sânge, concentrându-se în hematii, unde se găseşte o cantitate mare de FKBP12. Metabolizarea se face tot prin intermediul citocromului P450 CYP3A4, cu risc de interacţiuni cu alte medicamente(4).
Interacţiuni medicamentoase semnificative ale inhibitorilor de calcineurină:
-
inhibitorii CYP3A4 şi/sau ai glicoproteinei P cresc concentraţiile plasmatice ale inhibitorilor de calcineurină: clotrimazol, fluconazol, voriconazol, itraconazol, posaconazol, eritromicină, claritromicină, levofloxacină, ofloxacină; verapamil, diltiazem; nefazodon;
-
inductorii CYP3A4 scad concentraţiile plasmatice ale inhibitorilor de calcineurină: carbamazepină, fenitoină, fenobarbital; efavirenz; rifampicină(2,3).
Aspecte practice ale folosirii inhibitorilor de calcineurină(4)
Pacienţii trebuie să aibă o alimentaţie relativ constantă şi să ia medicamentele la intervale constante de timp faţă de mese, deoarece mesele bogate în grăsimi şi administrarea concomitentă cu alimente pot modifica concentraţiile plasmatice, distribuţia în organism şi eliminarea acestor medicamente.
Sucul de grepfrut creşte semnificativ concentraţiile plasmatice ale ambelor medicamente. Concentraţiile plasmatice ale ciclosporinei sunt crescute şi de ceaiul verde şi de turmeric.
Copiii au nevoie de concentraţii plasmatice mai mari de ciclosporină pentru acelaşi efect(11).
Reacţiile adverse ale inhibitorilor de calcineurină sunt prezentate în tabelul 3. Pentru limitarea fiecărui tip de toxicitate se monitorizează anumiţi parametri şi există mai multe posibilităţi terapeutice de minimizare şi control ale acestor reacţii adverse. De fiecare dată când e posibil, pentru limitarea toxicităţii se reduc dozele(4).
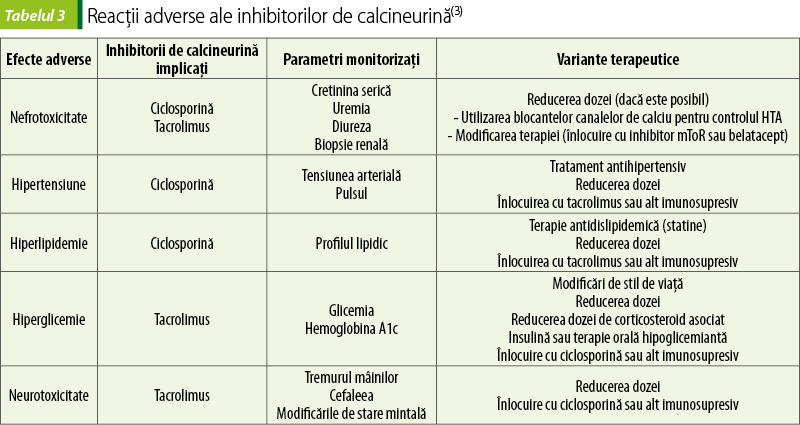
Nefrotoxicitatea inhibitorilor de calcineurină este problematică mai ales după transplantul renal, uneori fiind dificilă diferenţierea între toxicitate renală iatrogenă şi rejet de grefă(12).
Monitorizarea terapiei cu inhibitori de calcineurină trebuie să se facă de rutină, prin dozarea concentraţiilor plasmatice, iar dozele trebuie ajustate astfel încât să realizeze concentraţiile plasmatice ţintă, care scad în general pe măsură ce trece timp de la transplantare şi apare toleranţa la grefă. Monitorizarea terapiei pe criteriul farmacocinetic trebuie să se facă mai des în perioada instituirii tratamentului şi în perioada ajustării dozelor(4).
Inhibitori ai sintezei purinelor
Azatioprina şi acidul micofenolic şi derivaţii săi sunt antimetaboliţi, prevenind proliferarea limfocitelor. În prezent, azatioprină este mai puţin folosită posttransplant, în favoarea acidului micofenolic.
Acidul micofenolic şi micofenolatul de mofetil
Acidul micofenolic şi micofenolatul inhibă necompetitiv inosin monofosfat dehidrogenaza (IMPDH), enzima responsabilă de sinteza guanozinei. Scăderea sintezei nucleotidelor este însoţită de scăderea activităţii ADN polimerazei, cu scăderea proliferării limfocitelor.
Micofenolatul de mofetil este un prodrog (ester al acidului micofenolic) cu o bună absorbţie orală. Acidul micofenolic, instabil în mediul acid gastric, este condiţionat în forme enterosolubile, din care substanţa este mai lent cedată, cu atingerea concentraţiilor plasmatice maxime mai lent decât în cazul esterului. Acidul micofenolic se leagă în procent mare de albuminele plasmatice şi suferă circuit enterohepatic, cu realizarea unui al doilea peak plasmatic, la 6-12 ore de la administrare(4).
Acidul micofenolic şi micofenolatul de mofetil intră în regimuri imunosupresive posttransplant, alături de inhibitorii de calcineurină.
Reacţiile adverse frecvente sunt greaţă, vărsături, diaree, dureri abdominale şi evenimente hematologice (leucopenie şi anemie mai ales la doze mari). Rar, dar grav, poate să producă leucoencefalopatie multifocală progresivă(4,8).
Interacţiunile medicamentoase semnificative clinic pentru acidul micofenolic şi micofenolat sunt:
-
competiţie pentru eliminarea renală prin secreţie tubulară cu aciclovir (folosit pentru tratamentul şi profilaxia infecţiilor fungice la pacienţii transplantaţi), cu creşterea concentraţiilor plasmatice ale ambelor medicamente;
-
administrarea simultană cu antiacide conţinând aluminiu sau magneziu trebuie evitată (necesită distanţă între administrări), deoarece scade absorbţia imunosupresivului;
-
ciclosporina inhibă circuitul enterohepatic al acidului micofenolic, fiind necesare doze mai mari de acid micofenolic pentru obţinerea aceluiaşi efect(4).
Acidul micofenolic şi micofenolatul de mofetil sunt teratogene şi nu se administrează în sarcină şi nici la femei aflate la vârstă fertilă care nu utilizează contracepţie eficientă; nu se recomandă alăptarea pe perioada administrării(8).
Inhibitori ai mToR
Sirolimus (numit şi rapamicină) şi everolimus (un derivat sintetic al sirolimusului) sunt antibiotice macrolidice imunosupresoare. Ambele se leagă de imunofilina FK-binding protein-12 (FKBP12), cu formarea unui complex care se fixează apoi de o structură ţintă specifică mToR (mammalian target of rapamycin). mToR, sub influenţa IL-2, activează kinaze care reglează progresia ciclului celular din faza G1 în faza S, determinând proliferarea limfocitelor T. Sirolimus şi everolimus determină inhibarea răspunsului organismului la citokine, cu scăderea proliferării limfocitelor T. Datorită mecanismului de acţiune, aceste medicamente sunt cunoscute şi ca inhibitoare ale semnalului de proliferare(4).
Biodisponibilitatea orală a ambelor medicamente este scăzută. Distribuţia tisulară este largă. Ambele se metabolizează intens în ficat şi în intestin, sub acţiunea citocromului CYP3A4, şi ambele sunt substrat pentru glicoproteina-P, cu multiple interacţiuni medicamentoase.
Sirolimus şi everolimus determină mielosupresie doză-dependentă. Deoarece stimulează supraproducţia de lipoproteine, pot favoriza apariţia hipercolesterolemiei, şi pentru că inhibă lipoproteinlipaza pot determina hipertrigliceridemie. Rar, pot produce pneumonită interstiţială.
Sirolimus
Se foloseşte ca terapie de menţinere în transplant renal şi risc imunologic mic până la moderat, în asociere cu ciclosporină şi cu corticosteroizi(9).
Sirolimus determină întârzierea cicatrizării; administrarea sa poate începe la câteva luni după operaţie.
Everolimus
Everolimus se foloseşte în aceleaşi condiţii ca şi sirolimus, fiind autorizat şi pentru transplant cardiac(10).
Antagonişti ai receptorilor IL-2
Basiliximab
Basiliximab este un anticorp monoclonal himeric uman-murin, care se leagă cu afinitate ridicată la subunitatea alfa a receptorului pentru interleukină-2 (IL-2R) de pe celulele T activate. Astfel, inhibă proliferarea limfocitelor mediată de IL-2 şi diferenţierea lor, dar nu le epuizează(2).
Există raportări rare de edem pulmonar sever, noncardiogenic.
Daclizumab
Daclizumab este un alt antagonist al receptorilor IL-2, care nu este însă autorizat în Uniunea Europeană în farmacoterapia transplantului. O altă indicaţie a daclizumabului este scleroza multiplă(5).
Imunoglobuline antilimfocite
Imunoglobulinele antilimfocite şi antitimocite sunt obţinute prin imunizarea cailor sau iepurilor cu celule limfoide umane.
Imunoglobulinele antilimfocite sunt anticorpi policlonali care acţionează asupra limfocitelor T. Ca urmare a distrugerii (depletirii) sau inactivării celulelor T, imunitatea celulară şi reacţiile de hipersensibilitate întârziată sunt diminuate, în timp ce formarea de anticorpi umorali este puţin afectată.
Imunoglobulinele de iepure antilimfocite T umane se folosesc pentru intensificarea imunosupresiei necesare după transplantului alogenic de organe solide şi pentru pentru tratamentul episoadelor acute de rejecţie de organ rezistentă la corticosteroizi(13).
Din cauza lipsei de specificitate, reacţiile adverse pot fi numeroase. Produc mielosupresie doză-dependentă, cu leucopenie, anemie şi trombocitopenie. Reacţiile adverse potenţial severe sunt anafilaxia, hipotensiunea arterială, tahicardia, dispneea, urticaria şi erupţiile cutanate(4).
Alte medicamente folosite ca imunosupresive pentru prevenirea rejetului de grefă
Alemtuzumab
Alemtuzumabul este un anticorp monoclonal umanizat împotriva antigenului de suprafaţă CD52 aflat pe ambele tipuri de limfocite (T şi B), precum şi pe macrofage, monocite, eozinofile şi celule natural killer. După legarea alemtuzumabului de antigenul de suprafaţă CD52 se produce liza dependentă de anticorpi, care elimină complet limfocitele T şi B atât din sânge, cât şi din măduva osoasă şi organe. De aceea, se spune că alemtuzumab determină depletirea leucocitelor(4).
Belatacept
Belataceptul este un inhibitor al semnalului co-stimulator. Blochează liganzii costimulatori CD80 şi CD86 de pe celulele prezentatoare de antigen, prevenind astfel interacţiunea acestora cu clusterul de diferenţiere CD 28 de pe limfocitele T. Este blocat astfel semnalul 2 care ar fi condus altfel la apariţia calcineurinei şi a factorului nuclear-k b, cu activarea şi proliferarea limfocitelor T(4).
Belataceptul nu determină nefrotoxicitate şi este un candidat la înlocuirea inhibitorilor de calcineurină în terapiile posttransplant. Belataceptul determină frecvent anemie, neutropenie, diaree, infecţii ale căilor urinare, cefalee şi edem periferic. Reacţiile adverse rare sunt bolile limfoproliferative posttransplant (mai ales la pacienţi naivi ca expunere la virusul Epstein‑Barr) şi leucoencefalopatie progresivă multifocală(4).
Terapia de inducţie
Imediat după operaţia de transplant, scopul terapiei este prevenirea rejetului hiperacut şi a celui acut. Terapia imunosupresivă optimă trebuie să asigure supravieţuirea grefei, cu reacţii adverse minime ale medicaţiei asupra organismului primitor.
Dozele mari de imunosupresoare necesare pentru prevenirea rejetului pot duce, la administrare prelungită, la complicaţii grave (nefrotoxicitate, neurotoxicitate, infecţii, neoplazii, hipertensiune arterială, diabet zaharat iatrogen etc.). De aceea, se folosesc frecvent asocieri de medicamente, cu mecanisme de acţiune sinergice, ceea ce permite utilizarea unor doze mai mici din fiecare medicament individual, reducând astfel severitatea efectelor adverse(4).
Corticosteroizii fac frecvent parte din medicaţia administrată imediat după transplantare. Doze iniţial mari de metilprednisolon se administrează intravenos, cu scăderea treptată a dozei, în primele 5-7 zile postoperator, apoi se trece la administrare de prednison oral(4).
Terapia rejetului acut
Dacă se suspectează rejetul de grefă, se poate face terapie empirică sau se poate confirma diagnosticul prin biopsie şi apoi iniţia tratament. Tratamentul empiric se face cu doze mari de corticosteroizi, de obicei 500-1000 mg metilprednisolon intravenos, 1-3 doze. Dacă terapia empirică rezolvă situaţia, se ajustează terapia de menţinere pentru a furniza un grad mai ridicat de imunosupresie. Dacă biopsia confirmă rejetul şi/sau pacientul nu răspunde la dozele mari de corticosteroizi, se administrează anticorpi monoclonali sau policlonali(4).
Terapia de menţinere
Scopul terapiei de menţinere este prevenirea rejetului acut sau cronic cu medicaţie imunosupresoare care să aibă efecte adverse minime(4).
Se folosesc inhibitori de calcineurină (ciclosporină, tacrolimus), corticosteroizi, antimetaboliţi (azatioprină, micofenolat mofetil) sau inhibitori ai proliferării semnalului (blocantele mTOR sirolimus şi everolimus).
Toxicitatea asociată cu medicamentele imunosupresoare
Scăderea răspunsului imun pe care o determină medicamentele folosite după transplant de organ, dorită pentru menţinerea grefei, vine cu riscuri inerente asociate. În afara reacţiilor adverse despre care am vorbit, pot apărea următoarele:
Creşterea riscului de infecţii
Consecinţa inerentă a imunosupresiei este creşterea apariţiei infecţiilor virale, fungice, parazitare sau bacteriene, uneori cu microorganisme oportuniste. Printre cele mai severe, au fost raportate activări de infecţii latente cu polyomavirus (cu apariţia nefropatiei asociate cu polyomavirus) şi apariţia de leucoencefalopatie multifocală progresivă asociată virusului JC(5). Transplantul de ficat ridică probleme de recurenţă a hepatitei virale C, dar actuala terapie antivirală controlează în cele mai multe cazuri infecţia (atenţie însă la multiplele interacţiuni medicamentoase posibile)(4).
Orice simptom sau semn de infecţie trebuie detectat precoce şi instituit tratament intensiv antiinfecţios, deoarece organismul nu este capabil să se apere singur.
Creşterea riscului de malignitate
Deoarece sistemul imun este responsabil şi de apărarea anticanceroasă, deprimarea lui duce consecutiv la un risc crescut de neoplazii. Riscul apariţiei afecţiunilor maligne la transplantaţi este de trei ori mai mare raportat la populaţia generală. Cancerul de piele este cea mai frecventă formă de cancer la pacienţii transplantaţi(4).
Concluzii
Farmacistul poate face parte din echipa de supraveghere terapeutică a medicaţiei posttransplant. Alegerea medicaţiei posttransplant trebuie să se facă ţinând seama de specificul pacientului şi de polipatologia acestuia. Farmacistul se poate implica în titrarea dozelor pe baza concentraţiilor plasmatice şi a efectului clinic observat. Nu în ultimul rând, farmacistul poate detecta interacţiunile medicamentoase numeroase în care medicamentele folosite în imunosupresie pot fi implicate.
Bibliografie
- Hertl M, Smith JF. Overview of Transplantation. Merck Manual. Professional Version. 2018. https://www.merckmanuals.com/professional/immunology-allergic-disorders/transplantation/overview-of-transplantation. Accesat 25 octombrie 2018.
- Fake DF, Briggs AD. Immunopharmacology. În B Katzung. Basic & Clinical Pharmacology, 14th Edition. New York: Mc Graw Hill Education, 2017.
- Gabardi S, Martin ST, Olyaei AJ. Solid Organ Transplantation. În M Chisholm-Burns şi alţii. Pharmacotherapy Principles and Practic. McGraw-Hill: New York, 2016.
- Johnson H, Schonder K. Solid-Organ Transplantation. În J DiPiro, R Talbert şi G Yee. Pharmacotherapy: A Pathophysiologic Approach, 9th Edition. New York: McGraw-Hill, 2014.
- Chiriţă C, Marineci CD. Agenda Medicală, Ediţia de buzunar, 2018. Bucureşti: Editura Medicală, 2018.
- ANMDM. Prograf. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2018.
- EMA. Advagraf. Rezumatul caracteristicilor produsului. Ultima actualizare iulie 2018.
- EMA. CellCept. Rezumatul caracteristicilor produsului. Ultima actualizare august 2018.
- EMA. Rapamune. Rezumatul caracteristicilor produsului. Ultima actualizare august 2018.
- ANMDM. Certican. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2017.
- ANMDM. Sandimun Neoral. Rezumatul caracteristicilor produsului. Ultima actualizare septembrie 2016.
- Breda A et al. European Association of Urologi Guidelines. Renal Transplantation. [Interactiv] 2018. https://uroweb.org/guideline/renal-transplantation/#3_1. Accesat 26 octombrie 2018.
- ANMDM. Grafalon. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2017.
Articole din ediţiile anterioare
Terapia cu imunoglobuline umane normale
Introducerea în terapie a imunoglobulinelor umane normale a adus beneficii terapeutice pentru numeroase patologii. Imunoglobulinele sunt preparate ...
Tratamentul bolilor alergice în timpul sarcinii
Bolile alergice, incluzând rinita/rinoconjunctivita alergică, astmul și urticaria, sunt afecţiuni frecvente care apar la adulţii tineri, prin urmar...
Farmacoterapia unor afecţiuni dermatologice frecvente. Iatrogenie cu manifestări cutanate
Tratarea leziunilor dermatologice este o artă-cu-ştiinţă. Complexitatea leziunilor, multitudinea lor, evoluţia lor spre vindecare sau agravarea lor...
Imunoterapeutice (II)
Imunoterapeuticele au revoluţionat tratamentul unor afecţiuni severe. Anticorpii monoclonali şi alte medicamente biologice care acţionează la nivel...