Nutrition plays an important role in oncology, as cancer and its treatment can significantly affect the nutritional status of patients. During cancer therapy, patients may experience weight loss, decreased appetite, nausea and vomiting, diarrhea, or constipation, which may affect their overall health and ability to tolerate the treatment. Therefore, ensuring adequate nutrition can be important to maintain the nutritional status and the general health of patients during oncology therapy. Diet should be tailored to the individual needs of patients, taking into account health status, treatment and food tolerance. In addition, foods can have a direct impact on the growth and development of cancer cells, therefore some nutrients can have a protective effect against cancer. For example, foods rich in antioxidants, such as fruits and vegetables, can help prevent cell damage and reduce the risk of cancer. On the other hand, some foods and eating habits can increase the risk of cancer. For example, a high consumption of processed foods, foods high in saturated fat and sugar can increase the risk of cancer. Alcohol consumption and smoking are also known risk factors for cancer. New research combines precision oncology and precision nutrition by integrating information on tumor nutrition and metabolism, patient genomics and cancer cell metabolism, and even the patient’s microbiome that may lead to new approaches to cancer prevention. Good results have been achieved when molecularly targeted therapies and immunotherapy have been used to treat specific forms of cancer together with molecular oncology and molecular nutrition.
Terapia nutriţională în echilibrarea pacientului oncologic
Nutritional therapy in balancing the oncological patient
First published: 27 septembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.213.4.2023.8594
Abstract
Rezumat
Nutriţia are un rol important în oncologie, deoarece cancerul şi tratamentul acestuia pot afecta în mod semnificativ starea nutriţională a pacienţilor. În timpul terapiei oncologice, pacienţii pot prezenta pierderi în greutate, scăderea poftei de mâncare, greaţă şi vărsături, diaree sau constipaţie, ceea ce poate afecta starea generală de sănătate şi capacitatea de a tolera tratamentul. Prin urmare, asigurarea unei alimentaţii adecvate poate fi importantă pentru a menţine starea nutriţională şi starea generală de sănătate a pacienţilor în timpul terapiei oncologice. Alimentaţia trebuie să fie adaptată la nevoile individuale ale pacienţilor, ţinând cont de starea de sănătate, tratamentul şi toleranţa la alimente. În plus, alimentele pot avea un impact direct asupra creşterii şi dezvoltării celulelor canceroase – prin urmare, unii nutrienţi pot avea un efect protector împotriva cancerului. De exemplu, alimentele bogate în antioxidanţi, cum ar fi fructele şi legumele, pot ajuta la prevenirea daunelor celulare şi la reducerea riscului de cancer. Pe de altă parte, unele alimente şi obiceiuri alimentare pot creşte riscul de cancer. De exemplu, un consum ridicat de alimente procesate, alimente bogate în grăsimi saturate şi zahăr poate creşte riscul de cancer. De asemenea, consumul de alcool şi fumatul sunt factori de risc cunoscuţi pentru cancer. Noile cercetări combină oncologia de precizie şi nutriţia de precizie, prin integrarea informaţiilor privind nutriţia şi metabolismul tumorii, genomica pacientului şi metabolismul celulelor canceroase, chiar şi microbiomul pacientului, care pot duce la noi abordări pentru prevenţia cancerului. S-au obţinut rezultate bune când terapiile ţintite molecular şi imunoterapia au fost utilizate pentru a trata forme specifice de cancer împreună cu oncologia moleculară şi nutriţia moleculară.
Introducere
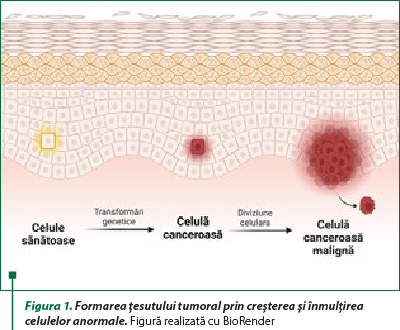
Cancerul este o patologie complexă manifestată prin acumularea de celule anormale care cresc şi care uneori se răspândesc în alte părţi ale corpului, putând afecta orice nivel de organizare a materiei vii. Procesul tumoral poate să apară aproape oriunde în corpul uman, care este alcătuit din trilioane de celule. În mod normal, celulele cresc şi se înmulţesc (printr‑un proces numit diviziune celulară) pentru a forma celule noi, pe măsură ce organismul are nevoie de ele. Când celulele îmbătrânesc sau se deteriorează, sunt distruse, iar celulele noi le înlocuiesc. Uneori, acest proces ordonat se alterează (figura 1), iar celulele anormale sau deteriorate cresc şi se înmulţesc(1).
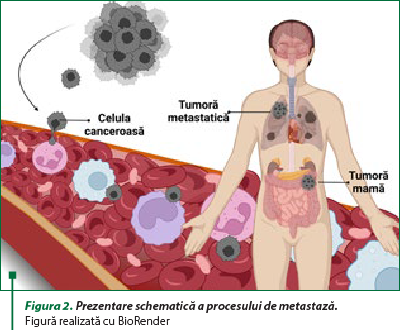
Tumorile maligne (canceroase) se răspândesc sau invadează ţesuturile adiacente (figura 2) şi pot chiar ajunge în locuri îndepărtate din organism (faţă de focarul primitiv de apariţie) pentru a forma noi tumori (un proces numit metastază).
Este foarte important să cunoaştem cauzele care duc la apariţia acestei patologii, care de multe ori nu are un prognostic favorabil. Cancerul este cauzat de anumite modificări ale genelor, unităţile fizice de bază ale moştenirii (figura 3). Aceste modificări genetice pot fi moştenite sau pot fi influenţate şi induse de anumiţi factori, precum: bacterii, virusuri, radiaţii UV, chimicale şi compuşi toxici, fumatul, un proces anormal de diviziune celulară(1). În general, cancerul poate fi declanşat de o combinaţie de factori, iar riscul de apariţie a bolii poate fi redus prin adoptarea unui stil de viaţă sănătos, evitarea expunerii la factorii de risc cunoscuţi şi efectuarea unor controale medicale regulate pentru depistarea precoce a cancerului.
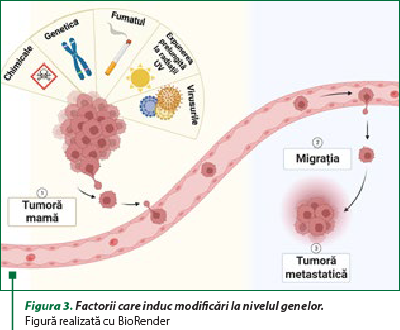
Este important de reţinut că, deşi aceşti factori pot creşte riscul de cancer, nu toţi oamenii care sunt expuşi la aceşti factori vor dezvolta această boală. De asemenea, unele persoane pot dezvolta cancer fără să fie expuse la aceşti factori de risc.
Pacientul oncologic prezintă un sistem imunitar slăbit, astfel crescând predispoziţia pentru infecţiile cu diferiţi germeni patogeni. Pe lângă schema de tratament, care poate să cuprindă chimioterapie, radioterapie, bioterapie, terapie hormonală şi poate chiar intervenţie chirurgicală în unele cazuri selectate, se impune modificarea patternului alimentar şi adaptarea acestuia în conformitate cu necesităţile pacientului. În perioada tratamentului, pacientul poate experimenta o serie de simptome care pot, de altfel, să îngreuneze şi să limiteze alimentaţia corectă a acestuia. Printre aceste posibile simptome amintim disfagia, xerostomia (senzaţie de gură uscată), disgeuzia (alterarea simţului gustativ), disosmia (percepţie modificată a mirosului), greaţă, vomă, diaree, constipaţie şi în unele cazuri chiar şi saţietate precoce(2).
Oncologia nutriţională cuprinde prevenirea cancerului la persoanele sănătoase, prevenirea recidivei cancerului la supravieţuitorii de cancer, dar şi impactul nutriţiei în rândul pacienţilor care urmează tratament pentru cancer. Totuşi, cel mai important obiectiv al oncologiei nutriţionale este cel de echilibrare a pacientului oncologic, atât din punctul de vedere al greutăţii corporale (malnutriţia fiind prezentă în cazul multor pacienţi oncologici, manifestată prin subnutriţie sau obezitate), cât şi din punctul de vedere al macro- şi micronutrienţilor care interacţionează în interiorul organismului (evitarea deficienţelor, dar şi a excesului). S-a dovedit că obezitatea este corelată cu un risc crescut de recurenţă a cancerului, dar şi cu un impact negativ asupra prognosticului şi supravieţuirii în general(2).
Menţinerea unei alimentaţii adecvate pe durata tratamentului oncologic este imperativă, deoarece poate diminua efectele secundare ale tratamentului, poate reduce intensitatea efectelor secundare şi ajută la optimizarea calităţii vieţii. Mulţi pacienţi îşi vizualizează dieta ca pe o modalitate prin care îşi pot spori eficacitatea tratamentului, minimiza toxicitatea legată de tratament sau chiar o modalitate de a ţinti cancerul în sine.
Nu doar alegerea cu atenţie a categoriilor de alimente şi ingrediente care intră în compoziţia felurilor alimentare este importantă, dar şi procesele de prelucrare pe care materia primă le suferă până în momentul în care ajunge în farfurie şi este consumată influenţează starea de sănătate, pe termen scurt, mediu şi lung.
Pierderea substanţelor fitochimice cu proprietăţi antioxidante poate apărea în timpul gătitului, ca urmare a degradării termice şi a migrării substanţelor (în special a compuşilor mai polari) în mediul de gătit. Pot apărea atât pierderea de antioxidanţi, cât şi formarea de prooxidanţi, mai ales când se găteşte la temperaturi ridicate, în special ca urmare a reacţiei Maillard.
Prepararea alimentelor conduce însă şi la creşterea biodisponibilităţii nutrienţilor cu proprietăţi antioxidante, ca urmare a facilitării eliberării din matricea alimentară. De exemplu, carotenoizii pot fi eliberaţi din asocierea lor cu proteinele din interiorul cromoplastelor. Includerea alimentelor bogate în carotenoizi în preparate precum tocana (mult utilizată în bucătăria mediteraneeană) a crescut conţinutul total de carotenoizi cu 36%. Explicaţia poate consta în faptul că are loc o degradare termică redusă, concomitent cu pierderi mari de apă. Alte tehnici de preparare fie s-au dovedit fără efect asupra biodisponibilităţii acestor compuşi, fie chiar au scăzut gradul de absorbţie cu 41%, procentaj constatat în cazul prăjirii.
În ceea ce priveşte unii polifenoli, precum acizii fenolici, trebuie precizat că ei se găsesc în vegetale strâns legaţi de fibre şi proteine alimentare. Polifenolii legaţi pot constitui o proporţie semnificativă din aportul zilnic total. Astfel, în fructe (mere, piersici şi nectarine), 80-90% din polifenoli se găsesc în formă legată. Prin urmare, factorii care eliberează polifenoli legaţi pot avea un impact semnificativ asupra nivelului general de polifenoli biodisponibili. Biodisponibilitatea slabă nu este totuşi neapărat dăunătoare. Componentele matricei alimentare pot acţiona ca transportori care permit fitonutrienţilor să ajungă în colon, unde sunt eliberaţi sub acţiunea bacteriilor intestinale.
De exemplu, fibrele din cereale transportă polifenolii până la colon şi îi eliberează la acest nivel, mai degrabă decât în porţiuni superioare ale tractului gastrointestinal. Aceasta poate avea beneficii pentru sănătate, fie la nivelul colonului propriu-zis, fie la nivelul întregului organism, după ce au fost absorbiţi. Rămâne deschis în continuare, ca domeniu de studiat, modul în care procesarea alimentelor poate influenţa atât biodisponibilitatea, cât şi consecinţele consumului de fitonutrienţi cu rol antioxidant şi antiinflamator, prezenţi în principalele grupuri de alimente din dieta mediteraneeană, asupra sănătăţii.
Tendinţele nutriţionale în patologia oncologică
Dieta medieraneeană este considerată „gold standard” în medicina preventivă, aceasta datorându-se, cel mai probabil, îmbinării proprietăţilor antioxidante şi antiinflamatorii ale nutrienţilor care se regăsesc în cantităţi importante în alimentele şi ingredientele caracteristice acestei diete. Practic, profesioniştii din domeniul sănătăţii recomandă tot mai mult dieta mediteraneeană în vederea aderării la un mod de viaţă sănătos şi benefic pe termen lung, datorită efectelor pozitive cardiovasculare, metabolice, cognitive şi antineoplazice constatate şi dovedite prin numeroase studii clinice. Dieta mediteraneeană este asociată cu scoruri de aderenţă bune la dieta echilibrată şi cu o calitate a vieţii clar îmbunătăţită, chiar şi în cazul populaţiilor nonmediteraneene.
Caracteristică pentru regiunea mediteraneeană este utilizarea pe scară largă a plantelor medicinale, cu scopul de a îmbunătăţi starea de sănătate şi de a preveni, atât cât este posibil, apariţia bolilor. Diverse studii epidemiologice indică faptul că unele dintre aceste plante reduc incidenţa bolilor inflamatorii şi a cancerului, prin inducerea apoptozei, împiedicând astfel proliferarea celulelor tumorale. Unele dintre aceste specii de plante, precum şofranul, ardeiul, usturoiul şi ceapa, sunt folosite în scopuri diverse, în timp ce altele, precum vâscul, mirtul, lavanda sau virnanţul au, mai degrabă, utilizări selective. De exemplu, şofranul exercită un efect chemopreventiv prin inhibarea proliferării celulare şi inducerea apoptozei, iar usturoiul inhibă creşterea celulelor canceroase, fără a afecta celulele sănătoase. Ceapa poate proteja împotriva anumitor forme de cancer pulmonar şi are efecte cardioprotectoare împotriva toxicităţii doxorubicinei. Speciile de ardei, dar şi vâscul, mirtul, lavanda şi virnanţul, au fost, de asemenea, studiate ca inductori ai apoptozei pe diverse linii celulare tumorale.
O caracteristică aparte a gastronomiei mediteraneene o constituie utilizarea pe scară largă a plantelor aromatice şi a condimentelor, atât pentru a îmbunătăţi calitatea felurilor culinare, din punctul de vedere al gustului şi al mirosului, cât şi pentru numeroasele efecte benefice pe care le au asupra organismului. Această utilizare are o tradiţie de mii de ani şi se datorează conţinutului ridicat al acestor plante în compuşi volatili şi aromatici, sintetizaţi de plante ca produşi ai metabolismului secundar. Există numeroase dovezi ştiinţifice care susţin, pe lângă efectul pe care îl au asupra preparatelor alimentare, şi proprietăţile antibacteriene, antifungice, antioxidante şi citotoxice şi care fac posibilă încadrarea ierburilor aromatice şi a condimentelor în categoria nutraceuticelor.
Dieta vegetariană, sau dieta vegană, se bucură de popularitate, este relativ uşor de implementat, iar dacă este abordată cu atenţie, nu vor apărea deficienţe nutriţionale. Evident, este necesară înlocuirea tuturor alimentelor de origine animală cu alimente de origine vegetală, deci este necesară o varietate extraordinară de alimente vegetale, iar asta înseamnă de fapt necesitatea unor resurse financiare suficiente pentru menţinerea unui asemenea stil alimentar. Există dovezi care susţin că vegetarienii au un risc scăzut de apariţie a cancerelor (mai ales cancerele de la nivelul sistemului gastrointestinal)(3). Raţionamentul din spatele acestei diete este legat de incidenţa crescută a cancerelor colorectale în rândul persoanelor care consumă carne, mai ales carne procesată. Aşadar, eliminarea acestora din dietă şi înlocuirea cu produse de origine vegetală, bogate în fitonutrienţi, ar preveni apariţia modificărilor neoplazice. Totuşi, în literatura de specialitate nu există studii clinice care să ateste efectele unei diete vegetariene asupra simptomelor induse de tratamentul oncologic şi nici rezultate în ceea ce priveşte abordarea acestui tip de dietă pentru echilibrarea pacienţilor oncologici.
Dieta macrobiotică presupune evitarea alimentelor care conţin substanţe cu potenţial toxic. Această dietă variază în funcţie de sexul individului, nivelul de activitate fizică, climatul din regiunea geografică (şi anotimpul în care se iniţiază dieta), pe lângă numeroase alte variabile. Este o dietă bogată în carbohidraţi şi cu conţinut scăzut în grăsimi, care provine din principii filozofice ce promovează un stil de viaţă sănătos. Dieta constă în consumul de cereale integrale în proporţie de 35% până la 50% (în funcţie de greutate), 25%-35% legume, 5%-10% supe, 5%-10% legume gătite/preparate termic şi alge marine/legume marine şi 5-10% peşte(2). Alimentele care sunt, în general, evitate într-o dietă macrobiotică standard includ carnea (inclusiv a păsărilor de curte), grăsimile animale, inclusiv untura sau untul, ouăle, produsele lactate, zaharurile rafinate şi alimentele care conţin îndulcitori artificiali sau alţi aditivi chimici, alimentele modificate genetic(4).
Nu există la momentul actual date raportate în literatura de specialitate care să susţină eficienţa acestei diete în cazul pacienţilor oncologici, atât ca parte complementară a schemei de tratament sau ca terapie alternativă. Recomandări referitoare la abordarea acestei diete în patologia oncologică nu pot fi făcute, din cauza lipsei de dovezi din studii clinice, studii observaţionale sau studii-pilot.
Dieta ketogenică (keto) a fost iniţial utilizată ca tratament adjuvant pentru unele cazuri de epilepsie, dar recent a câştigat popularitate pentru utilizarea în tratamentele standard pentru glioblastom. Dieta keto se caracterizează prin aportul predominant de lipide, unul scăzut de carbohidraţi, dar cu aport adecvat de proteine, şi are ca scop utilizarea predominantă a lipidelor ca sursă de energie. Teoria care stă la baza utilizării acesteia ca tratament adjuvant pentru cancer este reducerea disponibilităţii glucozei pentru formaţiunea tumorală, fiind ştiut faptul că tumorile se „hrănesc” cu glucoză. Această scădere a disponibilităţii glucozei poate fi obţinută prin inducerea stării de cetoză nutriţională (acizii graşi liberi sunt convertiţi în corpi cetonici), prin consumul ridicat de grăsimi şi restricţionarea carbohidraţilor. Aşadar, metabolizarea grăsimilor va avea loc prin oxidarea acizilor graşi prin producerea de corpi cetonici (acetoacetat, acetonă şi beta-hidroxibutirat). Dieta keto a fost studiată ca adjuvant în terapia oncologică atât pe modele animale, cât şi pe subiecţi umani. Numeroase studii din ultimii 60 de ani realizate pe animale au confirmat nu numai creşterea consumului de glucoză în celulele canceroase, dar au demonstrat, de asemenea, importanţa glucozei pentru supravieţuirea tumorii şi apariţia metastazelor(5).
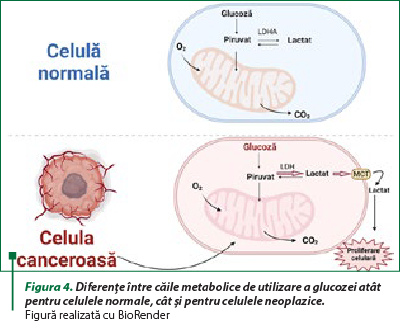
În 1926, Otto Warburg a observat că celulele neoplazice prezintă un fenotip metabolic unic, şi anume acestea captează niveluri crescute de glucoză şi produc cantităţi mari de lactat, chiar şi în prezenţa unor cantităţi suficiente de oxigen. Deci randamentul energetic al celulelor canceroase este extrem de scăzut, ele având nevoie de cantităţi mari de glucoză pentru a supravieţui. Efectul Warburg este asociat cu creşterea glicolizei ca urmare a reglării a numeroase enzime glicolitice majore. Acest efect se datorează cel puţin parţial faptului că celulele canceroase nu utilizează mitocondriile în aceeaşi măsură şi în acelaşi mod ca celulele sănătoase. Comparativ cu celulele normale ale organismului, celulele neoplazice sunt caracterizate de un metabolism crescut al glucozei şi de alterarea metabolismului oxidativ mitocondrial (figura 4). De asemenea, prezenţa mutaţiilor ADN-ului mitocondrial generează creşterea producţiei de radicali liberi (ROS) în timpul respiraţiei mitocondriale. Ca urmare a supraproducţiei de ROS în celulele tumorale, acestea devin dependente de metabolismul glucozei şi generează NADPH şi piruvat prin diverse căi metabolice (şuntul pentozo-fosfat şi glicoliză). Dieta ketogenică are rolul de a reduce capacitatea celulelor canceroase de a produce NADPH, ducând la creşterea nivelului stresului oxidativ în interiorul acestora (limitează regenerarea de NADPH)(5,6).
În figura 5 sunt rezumate potenţialele efecte benefice ale dietei ketogenice asupra organismului uman şi a diferitelor niveluri de organizare(7,8).
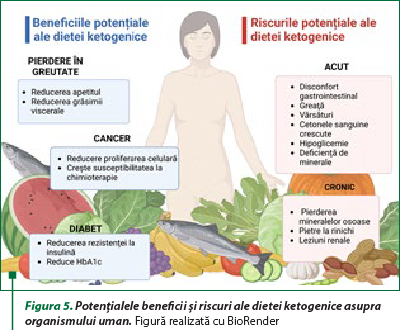
Este important să menţionăm că dieta keto impune anumite riscuri şi produce efecte adverse corelate cu ingestia crescută de grăsimi: letargie, greaţă, vomă, deshidratare, constipaţie, hipoglicemie, acidoză, stare de nelinişte, tremor. Efectele pe termen lung pot duce la perturbarea metabolismului lipidic, la hipoproteinemie, steatoză hepatică severă, deficienţe de minerale (seleniu, cupru, zinc), pierdere de masă osoasă, dezechilibre ale proceselor redox, cardiomiopatie şi nefrolitiază(5).
Alimentele recomandate în dieta keto sunt carnea grasă, organe interne de vită, porc, peşti graşi (somon, sardine, hering, macrou, ton, halibut, hamsii, păstrăv), ouă, brânză grasă, smântână, legume cu procentaj redus de amidon: avocado, broccoli, ciuperci, spanac, nuci, seminţe, migdale, alune, ulei de măsline extravirgin.
Cu toate acestea, cercetătorii ajung de multe ori la concluzii controversate în ceea ce priveşte eficienţa acestei diete. Un studiu recent efectuat la populaţia britanică a evidenţiat efectele negative ale dietei keto asupra sistemului cardiovascular, cu o predispoziţie spre dezvoltarea unor boli cardiovasculare. Se pare că dieta keto dublează riscul de apariţie a unui eveniment cardiovascular precum ateroscleroză, infarct miocardic şi accident vascular cerebral. Cercetătorii au comparat dieta low-carb high-fat (LCHF) a unui grup de 305 persoane cu dieta standard a unui grup de 1200 de persoane. Cercetătorii au descoperit că persoanele care au urmat dieta LCHF au avut niveluri mai ridicate de lipoproteine cu densitate scăzută, cunoscute şi sub numele de LDL, colesterol şi apolipoproteina B. Apolipoproteina B este o proteină care acoperă proteinele colesterolului LDL şi poate fi utilizat ca marker predictiv pentru bolile de inimă mai bine decât nivelurile ridicate de colesterol LDL. După o medie de 11,8 ani de urmărire şi după ajustarea pentru alţi factori de risc pentru boli de inimă, cum ar fi diabetul, hipertensiunea arterială, obezitatea şi fumatul, persoanele care au urmat o dietă LCHF au avut un risc de două ori mai mare de a avea mai multe evenimente cardiovasculare majore, cum ar fi înfundarea arterelor care au necesitat deschidere prin proceduri invazive (stentare), atac de cord, accident vascular cerebral (AVC) şi boală arterială periferică (BAP)(9).
Numeroase studii au demonstrat asocierea dietei keto cu LDL crescut (colesterolul „rău”), dar această constatare nu este consecventă în toate studiile. Dietele keto care sunt bogate în grăsimi saturate şi trans par a fi responsabile pentru creşterea nivelului de LDL colesterol(10,11). Când înlocuirea carbohidraţilor s-a realizat cu grăsimi naturale, sănătoase, dieta keto a fost asociată cu scăderea mortalităţii(11).
Aşadar, este imperios necesar să evidenţiem greşelile frecvente care duc la rezultate negative în urma dietei ketogenice.
Pacientul trebuie să se consulte iniţial cu medicul oncolog, iar ulterior cu un dietetician sau cu un medic nutriţionist, specializaţi în domeniul nutriţiei oncologice. Este important ca pacientul să înţeleagă că dieta keto nu presupune consumul unor cantităţi uriaşe de alimente grase, precum şi necesitatea distribuirii egale a cantităţilor la fiecare masă, pentru a evita consumul excesiv de alimente la una dintre mesele principale. În dieta keto se înlocuiesc carbohidraţii cu grăsimile, dar este extrem de important să avem în vedere consumul de grăsimi sănătoase, mono- şi polinesaturate, în detrimentul grăsimilor saturate, de origine exclusiv animală, sau al grăsimilor trans. Alegerea grăsimilor de calitate este extrem de importantă, astfel că este recomandată alegerea surselor de grăsimi sănătoase, şi anume grăsimi mononesaturate şi polinesaturate. Cele mai bune surse de grăsimi mononesaturate includ uleiul de măsline, uleiul de susan, tahini, avocado şi untul de nuci. Surse excelente de omega-3 includ uleiul de peşte, uleiul de seminţe de in şi uleiul de Sacha Inchi. Surse foarte bune de omega-6 sunt uleiul de luminiţa-nopţii, uleiul de floarea-soarelui şi uleiul de seminţe de dovleac.
O altă greşeală este reprezentată de consumul inadecvat de apă. Când dieta este bogată în carbohidraţi, excesul se depozitează în ficat şi în muşchi sub formă de glicogen, alături de o cantitate apreciabilă de apă. Carbohidraţii stimulează, de asemenea, secreţia de insulină, care trimite semnale către rinichi în vederea retenţiei de apă. În momentul în care nu mai avem aport de carbohidraţi din dietă, nivelul de insulină scade, iar toată apa conţinută în muşchi este eliberată la nivel renal. Consecinţa acestor mecanisme determină deshidratare, care poate rămâne susţinută chiar şi câteva săptămâni până când organismul se adaptează stării de cetoză.
Prevenirea deshidratării se realizează foarte simplu, printr-un aport crescut de apă pe parcursul zilei sau prin administrare de fluide intravenos în cazul în care hidratarea este ineficientă sau limitată de anumite modificări patologice.
Alte substanţe excretate renal în timpul stării de cetoză sunt electroliţii (sodiu, potasiu, magneziu). Aceste minerale sunt extrem de importante în menţinerea echilibrului acido-bazic, hidratării, a musculaturii, sistemului nervos şi a funcţionării celulare în ansamblu.
Sistemul imunitar al unui pacient oncologic este slăbit, aşadar orice dezechilibru duce la înrăutăţirea prognosticului, mai ales dacă este vorba de un dezechilibru al mineralelor. Deficitul de minerale poate să ducă la oboseală, epuizare fizică, cefalee şi diaree. Cea mai bună metodă prin care prevenim deficitul de electroliţi este aportul de alimente sănătoase, bogate în aceşti micronutrienţi.
Surse bogate în sodiu sunt reprezentate de: sarea de bucătărie, pâinea obţinută industrial, murăturile, seminţele de floarea-soarelui prăjite, scoici şi fructe de mare, fasole la conservă, produsele lactate, unele fructe şi legume.
Surse bogate în potasiu includ: avocado, broccoli, spanac, varză de Bruxelles, cartofi, cartofi copţi, roşii, ciuperci, fasole albă, sfeclă, linte, dovleac, seminţe de susan, migdale, nuci, banane, pepene galben, pepene roşu, kiwi, mure, nectarine, caise, prune, portocale, rodii, curmale, stafide, somon, carne de vită, iaurt grecesc, ouă.
Surse bogate în magneziu: seminţe de cânepă, seminţe de dovleac, seminţe de chia, seminţe de in, migdale, caju, nuci braziliene, cereale integrale (ovăz, orz, secară, pâine neagră sau pâine cu seminţe, quinoa, paste din grâu integral, orez brun), avocado, tofu, macrou, ton, somon, ciocolată neagră (80% cacao), banane, spanac, salată verde, varză Kale, pătrunjel, mărar, linte, broccoli, iaurt degresat, ouă.
Supa de oase reprezintă o sursă excelentă de minerale, fiind bogată în sodiu, potasiu, magneziu, clor şi fosfor. Cercetările au arătat că supa de oase poate influenţa în mod pozitiv evoluţia patologiei oncologice prin efectul de reducere a inflamaţiei (cunoscut fiind faptul că pacienţii oncologici prezintă un status proinflamator global). Nutrienţii prezenţi în supa de oase pot ajuta la ameliorarea inflamaţiei, care are ca rezultat aducerea organismului înapoi la echilibrul natural.
De asemenea, este important să nu neglijăm fibrele în dietă, deoarece acestea au multiple beneficii asupra organismului în ansamblu, iar lipsa unui aport optim poate induce dezechilibre cu răsunet puternic în cazul pacienţilor oncologici. Dieta keto presupune eliminarea carbohidraţilor, surse alimentare care sunt bogate în fibre. Totuşi, există multiple variante de alimente sănătoase cu conţinut redus de carbohidraţi, dar crescut de fibre, cum ar fi: avocado, seminţe de chia, migdale, nuci pecan, seminţe de in, seminţe de dovleac, seminţe de floarea-soarelui, legume cu frunze verzi, conopidă, varză şi nucă de cocos.
Alte abordări nutriţionale de actualitate la pacientul oncologic sunt reprezentate de postul intermitent şi restricţia calorică. Când vorbim despre restricţia calorică, ne referim la o reducere a numărului total de calorii cu 20-40%, fără a priva organismul de nutrienţii şi vitaminele zilnice necesare.
Postul intermitent este forma de dietă alimentară care presupune o perioadă de hrănire şi o perioadă de post alimentar care poate fi prelungit de la câteva ore până la câteva zile. Postul poate fi regăsit în literatura de specialitate în trei subcategorii: (i) post intermitent – zile de hrănire şi zile de post; (ii) post intermitent cu restricţie de timp – de obicei, perioada de hrănire e de câteva ore, 4-11 ore, iar perioada de post alimentar, între 13 şi 20 de ore; (iii) dietă care imită postul – presupune o restricţie calorică timp de câteva zile din lună. Toate cele trei tipuri de post au prezentat rezultate promiţătoare atât în prevenirea, cât şi în lupta împotriva cancerului(12).
Aşa cum s-a explicat anterior, particularitatea celulelor canceroase constă în metabolismul diferit faţă de celulele normale ale organismului, fiind predominant anaerob şi folosind glucoză; acest mecanism poartă numele de efect Warburg. Folosind teoria antiefect Warburg, care enunţă că reducerea glucozei duce la reducerea sau chiar stoparea metabolismului celulelor canceroase, postul intermitent şi restricţia calorică au venit ca terapii fireşti în lupta cu cancerul, alături de chimioterapie(13).
Postul are efect diferit asupra celulelor normale faţă de cele canceroase. Prin înfometare, celulele corpului sunt protejate, iar cele canceroase sunt „înfometate” – acest fenomen se numeşte „rezistenţă diferenţială la stres”. Când sunt înfometate, celulele canceroase nu se adaptează la lipsa hranei şi se opresc din înmulţire. Contrar acestora, celulele sănătoase rezistă la acest stres.
Un studiu clinic realizat pe şoareci cu melanom a arătat că un post de 72 de ore reduce toxicitatea chimioterapiei, protejând subiectul de efectele secundare dăunătoare. Aceste beneficii apar ca urmare a scăderii glucozei în organism, ceea ce duce la incapacitatea celulelor canceroase de a produce energie(14).
Postul împreună cu medicaţia specifică patologiei oncologice au dus la o reducere a metabolismului tumoral, la o imunitate mai puternică a pacienţilor şi la creşterea sensibilităţii tumorilor la tratament(12). Tratamentul chimioterapic poate fi potenţat de postul intermitent prin inhibarea glicolizei şi autofagia celulelor canceroase – acest proces a fost dovedit atât in vitro, cât şi in vivo(15,16). Când este folosit ca terapie complementară alături de chimioterapie, rezultatele indică o inhibare a creşterii tumorii în procentaj de 80-90%, comparativ cu cazurile în care chimioterapia este unica abordare terapeutică, aici înregistrându-se o inhibare a creşterii tumorale de 40-50%.
Medicamentele pentru chimioterapie sunt concepute pentru a ucide celulele canceroase care se multiplică rapid, dar pot deteriora şi celulele sănătoase din organism, inclusiv pe cele din măduva osoasă. Postul încurajează autoreînnoirea celulelor stem hematopoietice din măduva osoasă hematogenă(17).
Postul intermitent influenţează în mod pozitiv calitatea vieţii pacienţilor oncologici, în special în cazul pacientelor diagnosticate cu cancer de sân şi care au fost supuse chimioterapiei. Un studiu clinic realizat la supravieţuitoare ale cancerului de sân, care au fost alocate unui grup experimental de post intermitent cu restricţie de timp, a urmărit îmbunătăţirea calităţii vieţii la aceste paciente. Pentru evaluarea calităţii vieţii şi validarea rezultatelor, s-a folosit sistemul FACIT© (The Functional Assessment of Chronic Illness Therapy), însumând opt scale şi subscale diferite, care au făcut posibilă obţinerea unor concluzii pertinente. Cercetătorii au concluzionat că scorurile de oboseală au fost îmbunătăţite în urma postului intermitent cu restricţie de timp de 10:14 ore (14 ore perioada de post). Rezultate similare au fost obţinute şi în alt studiu, în care simptome precum oboseala, slăbiciunea şi efectele secundare chimioterapiei la nivel gastrointestinal au fost îmbunătăţite cu ajutorul postului intermitent(18).
Un studiu din 2020, realizat la 11 paciente cu cancer ovarian, opt cu cancer uterin şi o pacientă cu cancer cervical, toate sub tratament chimioterapic, a evidenţiat rezultate pozitive în ceea ce priveşte calitatea vieţii pacientelor ca urmare a postului intermitent (24 de ore înainte şi 24 de ore după şedinţele de chimioterapie)(19). Comparând numărul de ore de restricţie alimentară, posturile cu mai mult de 13 ore de pauză au o eficienţă mai mare decât cele mai scurte de 13 ore. Pacientele cu cancer de sân au prezentat un risc mai mare de mortalitate în cazul postului mai scurt de 13 ore şi un risc cu 36% mai mare de recidivă faţă de pacientele cu post mai lung de 13 ore(20).
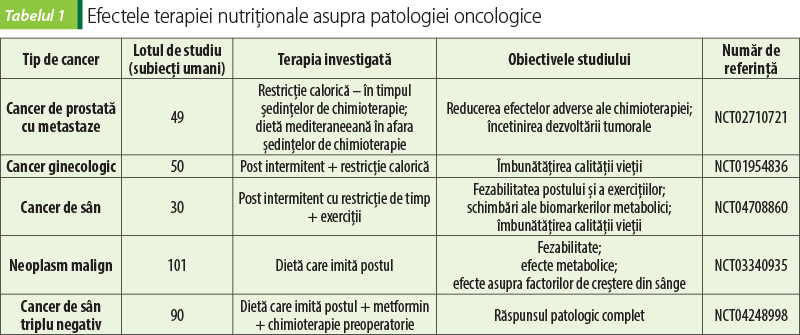
În prezent, există numeroase studii clinice în desfăşurare care utilizează diferite tipuri de post pentru îmbunătăţirea calităţii vieţii pacienţilor oncologici, dar şi studii care testează postul ca adjuvant în tratarea patologiei neoplazice alături de chimioterapie. În tabelul 1 se regăsesc o parte dintre aceste studii care vor fi finalizate în anii următori.
Suplimentele alimentare la pacientul oncologic
Suplimentele alimentare comercializate sub diferite denumiri sunt de multe ori utilizate pentru îmbunătăţirea aportului de nutrienţi. Acestea nu sunt destinate să servească drept singură sursă alimentară, ci să suplimenteze consumul de energie, proteine, grăsimi, carbohidraţi şi/sau fibre; şi, de asemenea, să contribuie la aportul de vitamine şi minerale. Recomandările pentru suplimente alimentare se realizează numai după evaluarea statusului clinico-biologic al pacientului, a statusului nutriţional, a necesităţilor nutriţionale, a funcţionalităţii sistemului gastrointestinal, a preferinţelor culinare, comorbidităţilor şi resurselor financiare.
Pacienţii oncologici necesită un aport adecvat de proteine de calitate pentru a menţine şi reconstrui masa musculară slabă. Acest aport ar trebui să provină în principal din alimentaţie (carne slabă, cereale integrale, produse lactate degresate), însă se admite şi administrarea de suplimente în cazul în care simptomele limitează alimentarea optimă a pacientului.
Administrarea de probiotice a devenit un trend la ora actuală, nu numai în cazul terapiei oncologice. Literatura de specialitate a demonstrat că suplimentarea cu probiotice în timpul radioterapiei, chimioterapiei sau în cazul combinării celor două poate preveni efectele secundare induse de tratament (diaree, în special), mai ales la pacienţii cu iradieri la nivelul abdomenului. Există studii care dovedesc beneficiile posibile ale probioticelor în cazul toxicităţii induse de imunoterapie, cu precădere la nivelul colonului(21).
Melatonina este un hormon endogen produs de glanda pineală, cu implicaţii în reglarea ritmului circadian, dar şi în ţintirea activităţii tumorale la pacienţii oncologici (în combinaţie cu chimioterapie sau radioterapie), precum şi în reducerea apariţiei simptomelor secundare tratamentului. Multiple studii au arătat rezultate superioare în cazul asocierii de melatonină în schema de tratament oncologic, comparativ cu utilizarea chimioterapiei ca terapie unică. Combinaţia dintre melatonină (supliment) şi chimioterapie poate să crească timpul de supravieţuire cu până la cinci ani, ajută la prevenirea sau reducerea efectelor secundare şi t oxicităţii legate de tratament care pot întârzia administrarea acestuia, poate determina reducerea dozelor, dar şi afecta în sens negativ calitatea vieţii pacienţilor oncologici(22).
Suplimentarea orală cu melatonină a fost asociată cu reduceri semnificative ale neuropatiei şi neurotoxicităţii, trombocitopeniei, cardiotoxicităţii, mielosupresiei, asteniei şi stării generale de rău. În literatura ştiinţifică de specialitate există multe dovezi care atestă eficienţa suplimentării cu melatonină la pacientul în tratament cu chimioterapie, radioterapie sau ambele, facilitând răspunsul tumorii, dar şi reducerea toxicităţii. Nu au fost înregistrate efecte secundare negative ale suplimentării orale cu melatonină. Aşadar, suplimentarea cu melatonină în combinaţie cu chimioterapie sau radioterapie la pacientul oncologic poate îmbunătăţi calitatea vieţii acestuia, dar şi prognosticul.
Aşa cum s-a precizat anterior, tratamentul oncologic poate determina efecte secundare neplăcute pentru pacient, printre care se numără diareea şi mucozita (radiomucozita), iar acestea pot întârzia tratamentul şi pot determina reduceri ale dozei administrate, afectând considerabil calitatea vieţii. Suplimentarea orală cu glutamină se pare că reduce toxicitatea tratamentului oncologic, cu precădere apariţia diareii şi mucozitei (ulceraţie a mucoasei orale), prin favorizarea unei regenerări şi vindecări rapide ale tractului gastrointestinal.
Glutamina este un aminoacid major care provine în principal din dietă şi are multiple roluri în organism (sinteza proteinelor, sursă de energie), fiind utilizat şi ca agent pentru vindecarea ţesuturilor deteriorate de chimioterapie şi radiaţii. Dovezile ştiinţifice susţin beneficiul suplimentării orale cu glutamină pentru reducerea simptomelor legate de tratament, dar şi pentru îmbunătăţirea şi menţinerea calităţii vieţii pacienţilor oncologici. Beneficiile nu se limitează la un status nutriţional superior, ci şi la reducerea leziunilor mucoaselor (mucozită, stomatită, farignită, esofagită, enterită).
Suplimentarea cu glutamină printr-o dietă bogată în proteine (10 g/zi), alături de dizaharide precum zaharoza şi/sau trehaloza, reprezintă o combinaţie care favorizează absorbţia glutaminei de către celulele mucoase. Acest efect locoregional poate reduce simptomele dureroase determinate de toxicitatea tratamentului asupra mucoaselor, dar şi ulceraţiile asociate cu chimioterapia şi radiaţiile din regiunea cefalică (cap şi gât), esofag, stomac şi intestin subţire(23).
Aportul adecvat de glutamină poate fi realizat printr-o dietă hiperproteică (10-20 g/zi), dar în cazul existenţei leziunilor se impune un consum mai ridicat, de 20-40 g/zi.
Acizii graşi polinesaturaţi (PUFAs) omega-3 sunt consideraţi imunonutrienţi şi sunt utilizaţi în mod frecvent în terapia nutriţională a pacienţilor oncologici datorită efectelor biologice numeroase, precum şi virtuţilor terapeutice. Acizii graşi omega-3 reprezintă componente esenţiale ale membranei celulare, având rol de modulare a fluidităţii acesteia, dar participă şi la mecanismele de semnalizare celulară. Datorită efectului antiinflamator, aceştia au fost studiaţi de specialiştii în domeniu pentru a depista dacă suplimentarea dietei pacienţilor oncologici se dovedeşte a fi utilă pentru îmbunătăţirea prognosticului şi a calităţii vieţii. Se pare că suplimentarea cu acizi graşi omega-3 este benefică mai ales în cancerele avansate, unde se asociază scăderea ponderală, riscul de malnutriţie sau chiar malnutriţia. Prin mecanisme celulare şi biochimice complexe, aceştia previn apariţia caşexiei sau a sindromului anorexie-caşexie, scad proteoliza, favorizează sinteza proteică, suprimă căi metabolice care duc la pierderea musculară şi induc pofta de mâncare(24).
Importanţa alimentelor funcţionale pentru echilibrarea pacientului oncologic
Având în vedere necesitatea de a echilibra nevoile metabolice ale pacienţilor oncologici pentru asigurarea aportului corect de energie, prevenirea oboselii, dar şi refacerea celulelor şi ţesuturilor, alegerile alimentare pot deveni dificile şi chiar pot să creeze confuzie.
Alimentele funcţionale sunt acele alimente care au beneficii pentru sănătate dincolo de furnizarea nutrienţilor de bază. Acestea au fost cercetate în amănunt, iar concluziile specialiştilor, realizate în urma analizei şi interpretării rezultatelor, susţin că alimentele funcţionale influenţează favorabil starea de sănătate şi reduc riscul de îmbolnăvire (figura 6). Ele mai sunt denumite şi „superalimente” datorită acestor efecte benefice care previn starea de boală şi îmbunătăţesc starea de sănătate a organismului.

Cercetările din domeniu sugerează că alimentaţia şi alimentele sunt corelate cu aproximativ 30% din toate cazurile de neoplasme din întreaga lume.
În cursul fenomenului de carcinogeneză au loc procese importante, şi anume oxidarea şi inflamaţia. Acestea sunt procese normale ale metabolismului şi fac parte din răspunsul imun al organismului într-o oarecare măsură, când nu sunt exacerbate de anumite dezechilibre celulare. În condiţii optime şi cu ajutorul „combustibilului” corect (nutrienţii din alimente), organismul este capabil să gestioneze aceste procese într-un mod în care să nu predispună sau să genereze starea de boală, ci mai degrabă să stabilească homeostazia corpului. Totuşi, este important să precizăm că nivelurile ridicate de stres oxidativ şi inflamaţie sunt problematice şi au un impact semnificativ asupra bolii.
Dieta occidentală (Western diet) şi stilul de viaţă modern (consum excesiv de zahăr, cereale rafinate, grăsimi saturate şi trans, ingrediente artificiale), stresul, dar şi expunerea la factorii toxici din mediul înconjurător predispun la instalarea dezechilibrului în organism, influenţând în mod negativ capacitatea sistemului imunitar de a reacţiona. În cazul pacienţilor cu cancer, despre care se ştie că prezintă un sistem imunitar compromis, este important să cunoaştem alimentele funcţionale, adică acele alimente despre care se ştie că au funcţii suplimentare şi îmbunătăţesc starea de sănătate şi starea generală de bine a organismului. Alimentele funcţionale nu numai că asigură aportul de macronutrienţi, de vitamine şi minerale, dar au capacitatea de a influenţa alte sisteme ale organismului, care într-un final conduc la fortificarea sistemului imunitar sau la întârzierea progresiei cancerului la pacienţii oncologici.
Alimentele funcţionale care ajută la echilibrarea pacientului oncologic
Legumele cu frunze verde-închis şi galbene, cum ar fi sfecla de argint, varza, spanacul, squash şi ardeiul gras galben, conţin luteină, care poate interfera cu progresia ciclului celulelor canceroase şi inhibă creşterea celulelor neoplazice.
Legumele crucifere, cum ar fi broccoli, conopida şi varza kale, susţin procesele de detoxifiere şi reduc riscul pentru diferite tipuri de cancer, inclusiv cancerul de sân, ficat şi intestin.
Leguminoasele precum lintea conţin squalene, care protejează împotriva dezvoltării cancerului colorectal, prin reducerea incidenţei creşterii şi dezvoltării polipilor.
Roşiile, pepenele verde, guava, caisele şi piersicile conţin licopen, care inhibă, de asemenea, creşterea celulară a diferitelor tipuri de cancer.
Fructele portocalii, cum ar fi piersicile, caisele şi portocalele, au efecte antiinflamatorii şi antitumorale.
Merele, strugurii, fructele de pădure, ceapa şi ceaiurile sunt bogate în flavonoide, care sunt utile în prevenirea şi tratarea diferitelor tipuri de cancer.
Murele şi afinele conţin în mod specific antociani, care suprimă activarea NF-κB (factorul nuclear kappa – amplificator de lanţ uşor al celulelor B), un puternic factor care favorizează proliferarea celulelor tumorale, angiogeneza şi supravieţuirea celulelor neoplazice.
Peştele şi uleiul de peşte sunt alimente antiinflamatoare şi reduc incidenţa cancerului de sân şi de prostată(25).
Concluzii
În ciuda progreselor recente în domeniul chimioterapiei, prognosticul pentru mulţi pacienţi cu cancer rămâne slab, iar cele mai multe tratamente actuale sunt limitate de evenimente adverse severe. Prin urmare, există o mare nevoie de abordări complementare care au toxicitate limitată asupra pacientului, în timp ce sporesc selectiv răspunsurile terapeutice în cancer. Dieta keto ar putea reprezenta o potenţială soluţie nutriţională care ar putea fi implementată rapid în scopul exploatării diferenţelor metabolice oxidative inerente dintre celulele neoplazice şi celulele normale, pentru a îmbunătăţi rezultatele terapeutice standard, prin creşterea selectivă a stresului oxidativ metabolic în celulele canceroase.
De asemenea, postul intermitent şi restricţia calorică au oferit rezultate promiţătoare atât pentru creşterea sensibilităţii tumorii la tratament şi îmbunătăţirea rezultatelor terapiei oncologice, cât şi pentru îmbunătăţirea calităţii vieţii atât a pacienţilor, cât şi a supravieţuitorilor.
Cercetătorii atrag atenţia asupra importanţei echilibrării pacientului oncologic prin aportul crescut de alimente funcţionale, naturale, neprocesate şi chiar a suplimentării anumitor substanţe bioactive în situaţiile în care aportul din alimentaţie nu este posibil sau există anumite tulburări de absorbţie. Aceste alimente au capacitatea de a întări sistemul imunitar şi de a îmbunătăţi calitatea vieţii pacienţilor oncologici, care este de cele mai multe ori afectată.
Desigur, aceste alimente funcţionale nu au capacitatea de a vindeca patologia neoplazică, dar sunt capabile să influenţeze dezvoltarea şi progresia cancerului, să echilibreze într-o oarecare măsură organismul care luptă împotriva procesului tumoral şi să menţină starea de vitalitate a organismului.
În concluzie, nutriţia joacă un rol important în oncologie, atât în prevenţia cancerului, cât şi în menţinerea stării nutriţionale şi a stării generale de sănătate a pacienţilor în timpul terapiei oncologice. Este foarte important să se acorde o atenţie deosebită nutriţiei şi să se asigure o alimentaţie adecvată şi echilibrată pentru a ajuta pacienţii să facă faţă mai bine terapiei şi să-şi îmbunătăţească calitatea vieţii.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
NCI. What Is Cancer?. https://www.cancer.gov/about-cancer/understanding/what-is-cancer (accessed 19 April 2023).
-
PDQ Supportive and Palliative Care Editorial Board. Nutrition in cancer care: Health professional. PDQ Cancer Information Summaries. 2019;1–62.
-
Watling CZ, Schmidt JA, Dunneram Y, et al. Risk of cancer in regular and low meat-eaters, fish-eaters, and vegetarians: a prospective analysis of UK Biobank participants. BMC Med. 2022;20(1):1–13.
-
Kushi LH, Cunningham JE, Hebert JR, et al. The Macrobiotic Diet in Cancer. J Nutr. 2001;131:3056S-3064S.
-
Allen BG, Bhatia SK, Anderson CM, et al. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014;2:963–970.
-
Asare-Werehene M, Shieh D-B, Song YS, et al. Chapter 35: Molecular and Cellular Basis of Chemoresistance in Ovarian Cancer. In: The Ovary, Third Edition. 2019; pp. 575–593.
-
Dowis K, Banga S. The potential health benefits of the ketogenic diet: A narrative review. Nutrients. 2021;13(5):1654.
-
Klement RJ. Beneficial effects of ketogenic diets for cancer patients: a realist review with focus on evidence and confirmation. Medical Oncology. 2017;34(8):132.
-
CNN. ‘Keto-like’ diet may be associated with heart disease, according to new research. https://edition.cnn.com/2023/03/05/health/keto-low-carb-high-fat-diets-heart-disease/index.html (accessed 22 April 2023).
-
Kirkpatrick CF, Bolick JP, Kris-Etherton PM, et al. Review of current evidence and clinical recommendations on the effects of low-carbohydrate and very-low-carbohydrate (including ketogenic) diets for the management of body weight and other cardiometabolic risk factors: A scientific statement from the National Lipid Association Nutrition and Lifestyle Task Force. J Clin Lipidol. 2019;13:689-711.e1.
-
Seidelmann SB, Claggett B, Cheng S, et al. Dietary carbohydrate intake and mortality: a prospective cohort study and meta-analysis. Lancet Public Health. 2018;3(9):e419–e428.
-
Tang D, Tang Q, Wei H, et al. Fasting: From Physiology to Pathology. Advanced Science. 2023;10(9):2204487.
-
Kikomeko J, Schutte T, van Velzen MJM, et al. Short-term fasting and fasting mimicking diets combined with chemotherapy: a narrative review. Ther Adv Med Oncol. 2023;15:17588359231161418.
-
Eriau E, Paillet J, Kroemer G, et al. Metabolic Reprogramming by Reduced Calorie Intake or Pharmacological Caloric Restriction Mimetics for Improved Cancer Immunotherapy. Cancers. 2021;13(6):1260.
-
Weng ML, Chen WK, Chen XY, et al. Fasting inhibits aerobic glycolysis and proliferation in colorectal cancer via the Fdft1-mediated AKT/mTOR/HIF1α pathway suppression. Nat Commun. 2020;11(1):1869.
-
Bianchi G, Martella R, Ravera S, et al. Fasting induces anti-Warburg effect that increases respiration but reduces ATP-synthesis to promote apoptosis in colon cancer models. Oncotarget. 2015;6(14):11806–11819.
-
Tiwari S, Sapkota N, Han Z. Effect of fasting on cancer: A narrative review of scientific evidence. Cancer Sci. 2022;113(10):3291–3302.
-
Bauersfeld SP, Kessler CS, Wischnewsky M, et al. The effects of short-term fasting on quality of life and tolerance to chemotherapy in patients with breast and ovarian cancer: A randomized cross-over pilot study. BMC Cancer. 2018;18(1):476.
-
Riedinger CJ, Kimball KJ, Kilgore LC, et al. Water only fasting and its effect on chemotherapy administration in gynecologic malignancies. Gynecol Oncol. 2020;159(3):799–803.
-
Clifton KK, Ma CX, Fontana L, et al. Intermittent fasting in the prevention and treatment of cancer. CA Cancer J Clin. 2021;71(6):527–546.
-
Badgeley A, Anwar H, Modi K, et al. Effect of probiotics and gut microbiota on anti-cancer drugs: Mechanistic perspectives. Biochim Biophys Acta Rev Cancer. 2021;1875(1):188494.
-
Wang L, Wang C, Choi WS. Use of Melatonin in Cancer Treatment: Where Are We? International Journal of Molecular Sciences. 2022;23(7):3779.
-
Anderson PM, Lalla R V. Glutamine for Amelioration of Radiation and Chemotherapy Associated Mucositis during Cancer Therapy. Nutrients. 2020;12(6):1675.
-
Freitas RDS, Campos MM. Protective Effects of Omega-3 Fatty Acids in Cancer-Related Complications. Nutrients. 2019;11(5):945.
-
Functional Foods in Cancer Care: Nutrition, Benefits & More. https://www.miog.com.au/blog/functional-foods (accessed 28 April 2023).
Articole din ediţiile anterioare
Plantele medicinale proaspete în stimularea imunităţii
Sistemul imunitar este mecanismul de apărare dezvoltat şi menţinut de corpul uman pentru a respinge germenii, virusurile şi alte substanţe străine....
Studiul activităţii antioxidante a unor produse vegetale indigene
Lucrarea prezintă rezultatele obţinute la determinarea activităţii antioxidante a trei produse vegetale indigene: păducel (Crataegus oxyacantha) fl...
Alimente cu efect detoxifiant
Dietele de detoxificare sunt folosite pentru eliminarea diferitelor toxine din organism, dar şi în scopul pierderii greutăţii. Acest lucru e posibi...
Dieta mediteraneeană – de la plan alimentar şi stil de viaţă la includerea în ghidurile terapeutice
În ultimii ani, tendinţa generală este de a se acorda o atenţie tot mai mare nutriţiei şi stării de sănătate, evaluate pe tot parcursul ciclului vi...