Basal cell carcinoma (BCC) is the most common form of skin cancer, originating from the basal cells of the epidermis and skin appendages. Tumors have a slow evolution, reduced malignancy, rare metastasis, but there are also extremely recurrent forms. The main symptom of basal cell carcinoma is the slow onset of an incurable tumor, usually painless, that bleeds after trauma. BCC should be considered in any patient with a skin lesion on sun-exposed areas, which does not heal in 3-4 weeks and has a slow evolution, especially if it has a central ulceration. Patients with a history of treated BCC have an increased risk of developing a new skin tumor. The treatment of choice is surgical excision, in inoperable or recurrent cases radiotherapy being used. The prognosis is usually excellent if the lesion is removed completely; its progression is associated with significant morbidity. It rarely produces regional or distant metastases, except for the meta-typical form.
Carcinomul bazocelular – factori de risc şi strategie terapeutică
Basal cell carcinoma – risk factors and therapeutic strategy
First published: 03 martie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/MED.5.1.2021.4586
Abstract
Rezumat
Carcinomul bazocelular (CBC) este cea mai frecventă formă de cancer cutanat, provenind din celulele bazale ale epidermului şi anexelor tegumentare. Tumorile au o evoluţie lentă, malignitate redusă, metastazare rară, dar există şi forme extrem de recidivante. Principalul simptom al carcinomului bazocelular este apariţia lentă a unei formaţiuni tumorale care nu se vindecă, de obicei nedureroasă, care sângerează după traumatizare. CBC trebuie avut în vedere la orice pacient cu o leziune cutanată apărută pe zonele expuse la soare, care nu se vindecă în 3-4 săptămâni şi are evoluţie lentă, mai ales dacă prezintă o denivelare centrală. Pacienţii cu istoric de CBC tratat prezintă un risc crescut de a dezvolta o nouă tumoră cutanată. Tratamentul de elecţie este excizia chirurgicală, în cazurile inoperabile sau recidivate fiind folosită radioterapia. Prognosticul este de obicei excelent dacă leziunea este îndepărtată complet; progresia acesteia este asociată cu o morbiditate semnificativă. Produce rareori metastaze regionale sau la distanţă, cu excepţia formei metatipice.
Introducere
Carcinomul bazocelular (CBC) este cea mai frecventă formă de cancer cutanat, provenind din celulele bazale ale epidermului şi anexelor tegumentare. Incidenţa lui creşte cu vârsta; persoanele între 55 şi 75 de ani au o incidenţă de 100 de ori mai mare decât cele sub 20 de ani(1). Pacienţii sub 40 de ani fac de obicei forme superficiale şi localizate mai ales pe trunchi; la copii sunt foarte rare în absenţa altor patologii (circa 100 de cazuri descrise, localizate pe cap sau gât)(2,3).
Incidenţa la bărbaţi este cu 30% mai mare decât la femei, mai ales cea a tipului superficial(1,4,5,6). Există variaţii mari ale incidenţei cazurilor, urmărind tiparul expunerii la soare, ţările nordice având mai puţine cazuri decât cele mediteraneene şi cele sudice, astfel că în Australia incidenţa este de 40 de ori mai mare decât în Finlanda(4,6,7).
85% din CBC apar la nivelul feţei, capului (inclusiv scalp) şi gâtului(8), afectând mai ales pielea etajului mijlociu şi superior al feţei, în special regiunea şanţului nazogenian, orbitară (unghiul intern al ochiului), fruntea, urechea, gâtul, mai rar pielea capului, trunchiului şi foarte rar pe membre. Tumorile au o evoluţie lentă, malignitate redusă, metastazare rară, dar există şi forme extrem de recidivante. Toţi pacienţii cu istoric de CBC tratat prezintă un risc crescut de a dezvolta o nouă tumoră cutanată. Tratamentul de elecţie este excizia chirurgicală, în cazurile inoperabile sau recidivate fiind folosită radioterapia. Prognosticul este de obicei excelent dacă leziunea este îndepărtată complet; progresia acesteia este asociată cu o morbiditate semnificativă. Produce rareori metastaze regionale sau la distanţă, cu excepţia formei metatipice(8).
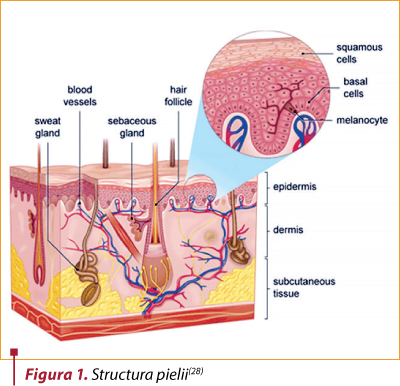
Anatomia pielii şi patogeneză
Epidermul este alcătuit dintr-un epiteliu scuamos stratificat, keratinizat, care se autoreînnoieşte. Este împărţit în mai multe straturi, din profunzime spre suprafaţă: stratul bazal, stratul spinos, stratul granular, stratul clar (lucidum) şi stratul cornos. Primele trei straturi profunde sunt cele metabolic active, celulele schimbându-şi forma pe măsură ce se diferenţiază. Straturile superficiale suferă keratinizare terminală, eliminându-se progresiv(9).
Carcinomul bazocelular derivă din celulele bazale ale epidermului. Acestea prezintă o varietate de mutaţii care declanşează proliferarea. Cea mai frecventă alteraţie genetică este mutaţia genei PTCH1, care codifică Patched, receptorul SHH (sonic hedgehod receptor). Tumorile care au gena PTCH normală au mutaţii ale genei SMO, responsabilă de receptorul Smoothened (SMO). Ambele proteine fac parte din calea de semnalizare Hedgehog, esenţială pentru proliferarea celulară şi dezvoltare. A doua anomalie ca frecvenţă este reprezentată de mutaţiile genei supresoare p53, produsă de acţiunea radiaţiilor ultraviolete UV. Interacţiunea celulelor canceroase cu fibroblastele stromale este importantă pentru continuarea creşterii tumorale şi supravieţuirea lor(10).
Factori de risc
Apariţia carcinomului bazocelular a fost asociată cu: factori de mediu (expunerea la raze UV şi ionizante, expunerea cronică la arsenic, fumatul, alcoolul), factori genetici şi antecedente (variante genetice predispozante şi sindroame genetice, fenotipul, istoric de CBC sau imunosupresie) şi alţi factori a căror legătură este mai puţin evidentă (nevii sebacei, infecţia cu papilomavirus)(1).
Expunerea la soare este cel mai important factor de mediu, corelat direct cu sensibilitatea la radiaţia solară, determinată de tipul de ten şi de obiceiurile de bronzare. Pielea şi ochii deschişi la culoare, părul roşcat, pistruii, strămoşii din nordul Europei, vârsta înaintată şi un număr crescut de arsuri solare în antecedente reprezintă tot atâţia factori de risc(1). În Australia, numărul de epitelioame determinate de expunerea la UV este dublu faţă de cel din ţările cu expunere redusă la radiaţii solare(11). Fenotipurile cutanate Fitzpatrick I şi II(12) prezintă risc dublu de cancer bazocelular din cauza răspunsului specific la radiaţiile UV(10,13). Expunerea la soare în timpul copilăriei pare a avea un rol mai nociv decât expunerea adulţilor(14,15,16), deşi s-au dovedit a fi importante frecvenţa şi intensitatea expunerii(17). Saloanele şi lămpile UV de bronzat deteriorează şi îmbătrânesc ireversibil pielea, o şedinţă de 20 de minute fiind comparabilă cu 4 ore la soare. Metaanaliza din 2012 a lui Wehner et al.(18) arată că persoanele care au utilizat solarele au un risc relativ de CBC mai mare (RR 1,29), mai ales dacă au început înainte de vârsta de 20 de ani (RR 1,40).
Fototerapia PUVA (psoralen plus ultraviolet A light), utilizată pentru boli precum psoriazisul, creşte riscul de cancer – mai ales spinocelular(19). La fel, radiaţiile ionizante folosite în scop antiinflamator sau pentru tratamentul cancerelor sunt asociate cu un risc crescut de CBC(20,21).
Expunerea cronică la arsenic, din ape contaminate, fructe de mare sau medicamente, poate duce la apariţia CBC superficial multicentric, mai ales în prezenţa unor factori genetici(1).
Existenţa genelor predispozante la anumiţi pacienţi este asociată cu apariţia CBC după expunerea la soare a persoanelor mai tinere, de sex masculin şi în mai multe localizări, comparativ cu cei care nu au genele.
Sindroamele genetice care favorizează dezvoltarea CBC la vârste tinere sunt: sindromul Gorlin al nevilor cu celule bazale (autozomal dominant), xeroderma pigmentosum (autozomal recesiv), sindromul Bazex-Dupre-Christol sau atrofoderma foliculară cu CBC (X-linkat dominant), albinismul oculo-cutanat (autozomal recesiv), sindroamele Rombo, Muir-Torre etc.(1,10)
Antecedentele personale de CBC sunt importante, deoarece aproape jumătate din pacienţii care au avut un carcinom vor face altul în următorii 5 ani(22,23).
Imunosupresia, mai ales după transplantul de organe sau în infecţiile cu HIV, favorizează dezvoltarea CBC, deşi carcinoamele spinocelulare apar mai frecvent în aceste condiţii(1).
Simptome/examen local
Formaţiunile suspecte de carcinom bazocelular sunt localizate de obicei pe faţă, cap (inclusiv scalp), gât şi mâini, rareori pe palme sau tălpi, şi prezintă o creştere lentă – aproximativ 0,5 cm în 1-2 ani. Caracteristici: papule cerate cu depresiune centrală şi margini elevate, aspect perlat sau translucid, teleangiectazii, eroziuni sau ulceraţii – de obicei centrale şi pigmentate, sângerări după traumatisme, secreţii şi cruste(8). Anamneza va căuta antecedente de iradiere sau tumori deoarece în cazul recidivelor este de aşteptat invazia profundă, ca şi agresivitatea crescută(8).
Clasificare clinico-patologică
Pe baza comportamentului biologic distinct, au fost descrise următoarele tipuri de CBC(1,8).
-
Nodular: cel mai frecvent (60%-80%); de obicei, o papulă rotundă, de culoarea pielii, cu ulceraţie centrală, margini perlate şi teleangiectazii. Variante: chistic (conţinut mucinos), pigmentat (uneori greu de diferenţiat de melanom), keratozic (diagnostic histopatologic).
-
Superficial (15% din CBC): mai frecvent la bărbaţi, mai ales la nivelul treimii superioare a trunchiului sau pe umeri; este o pată sau placă eritematoasă, bine delimitată, cu solzi de culoare albă sau cruste, imitând psoriazisul sau o eczemă – dar are caracter lent progresiv şi multicentric. Este descris în expunerea la arsenic.
-
Morfeiform/sclerozant (5-10% din cazuri): imită clinic o cicatrice, din cauza proliferării fibroblastelor şi depunerii crescute de colagen. Apare ca o placă în plan cutanat, albă sau gălbuie, sclerotică, fibroasă şi fermă la atingere, cerată, care ulcerează rareori – greu de diagnosticat, necesită tehnica Mohs pentru excizie.
-
Infiltrativ: tumora infiltrează dermul între fibrele de colagen, făcând dificilă identificarea clinică a marginilor. Este o placă fermă, uşor elevată, gălbuie, cu margini imprecis delimitate. Din cauza modelului de creştere, se recomandă tehnica micrografică Mohs pentru excizie, celelalte proceduri (electrodesicaţie plus chiuretaj) având o rată mare de recidivă(8).
-
Micronodular: formă agresivă, deşi aparent bine delimitat; este un nodul mic (<0,15 mm), alb-gălbui, de consistenţă fermă, ulcerează rar.
Au fost descrise multe alte subtipuri de CBC: metatipic (agresiv, combinat cu carcinomul spinocelular), infundibulo-chistic, folicular, pleomorfic şi fibroepitelial (fibroepiteliomul lui Pinkus, subtip rar, nedureros, pe toracele posterior). Din punct de vedere clinic şi terapeutic, este importantă clasificarea propusă de Ghidul Colegiului Regal al Patologiştilor din Londra, actualizat în 2014(24), care împarte tipurile de CBC în forme cu malignitate scăzută (cu creştere lentă şi risc mic de invazie locală) şi forme cu malignitate crescută (agresive, cu potenţial de invazie).
Tipurile cu malignitate scăzută (cu creştere lentă) sunt: CBC nodulo-chistic (varianta cea mai frecventă, 60-80% din cazuri), CBC superficial (lichen pagenoid sau eritematos, pe trunchi sau abdomen), CBC fibroepitelial (fibroepiteliomul Pinkus), CBC cheratozic (pilos), CBC adenoid, CBC pigmentar (de diferenţiat de melanomul malign).
Tipurile cu malignitate crescută (cu creştere agresivă) sunt: CBC infiltrativ (invazia perineurală şi cea perivasculară sunt întâlnite frecvent), CBC morfeiform (sclerozant, fibrozat, cu varianta cheloidă), CBC micronodular, CBC bazoscuamos (metatipic), asociat cu un risc mai mare de invazie perineurală, vasculară şi chiar metastazare(24).
Diagnostic
Pentru stabilirea diagnosticului pozitiv de CBC, pledează anamneza (localizarea pe zonele cu expunerea cronică la soare, mai ales în treimea superioară a corpului), aspectul clinic sugestiv şi evoluţia lentă. Folosirea dermatoscopiei creşte acurateţea diagnosticului, reduce necesitatea biopsiilor şi poate oferi asistenţă pentru alegerea tratamentului nonchirurgical şi pentru evaluarea rezultatelor tratamentului chirurgical(25). Aspectele specifice CBC la dermatoscopie sunt: vascularizaţia ramificată, cuiburile ovoide gri-albăstrui, ulceraţia, lipsa reţelei pigmentare (caracteristică leziunilor melanocitare)(1). O metaanaliză a lui Reiter et al.(26) găseşte pentru dermatoscopie o sensibilitate de 91% şi o specificitate de 95%.
Biopsiile sunt recomandate dacă: leziunea nu prezintă caracteristici tipice pentru CBC, anamneza nu este specifică sau dacă aspectul este sugestiv pentru un CBC cu risc crescut de recidivă(1).
Evoluţia şi factorii prognostici
Deşi metastazează rar, CBC poate fi agresiv prin invazia locală, depăşind pielea, erodând structurile, inclusiv osul (de unde denumirea de ulcus rodens). Factorii asociaţi cu un risc mare de recidivă şi cu un prognostic mai rezervat sunt reprezentaţi mai ales de mărimea tumorii, localizarea acesteia în zonele cu risc şi de caracteristicile patologice agresive.
Sunt descrise zone cu risc ridicat, moderat şi scăzut. Astfel, localizările „în mască” de la nivelul feţei în aşa-numită zonă H (H=high; risc ridicat) sunt zonele laterale ale feţei (de la tâmple spre bărbie, cuprinzând urechile) şi zona centrală a feţei (periorbital, coborând spre nas, gură şi bărbie). Tot din zona H fac parte mâinile, tălpile şi regiunea ano-genitală. Teritoriile din zona M (M=moderat) cuprind restul frunţii, obrajii şi mandibula, scalpul şi gâtul, împreună cu zona pretibială. Zonele L (L=low; risc scăzut) sunt reprezentate de restul trunchiului şi extremităţi, după cum se observă în figura 2(27).
Combinând dimensiunea tumorii cu localizarea în diferite zone ale corpului, cercetătorii au descris riscurile scăzut, intermediar sau crescut de recidivă, prezentate în tabelul 1.


Strategie terapeutică
Tratamentul carcinomului bazocelular este necesar din cauza invaziei locale, a efectelor agresive şi distructive ale acestuia asupra tegumentului şi ţesuturilor subiacente şi chiar a riscului de metastazare (0,002-0,5%)(10). În alegerea opţiunii terapeutice trebuie prioritizată tehnica ce oferă cea mai ridicată rată de vindecare, stabilită în funcţie de localizarea, dimensiunea şi agresivitatea patologică, acestea reflectând riscul de invazie în profunzime şi de recidivă după tratament(31). Intervin şi alţi factori, reprezentaţi de: vârsta şi antecedentele pacientului, numărul de leziuni prezente, morbiditatea şi tolerabilitatea tratamentului.
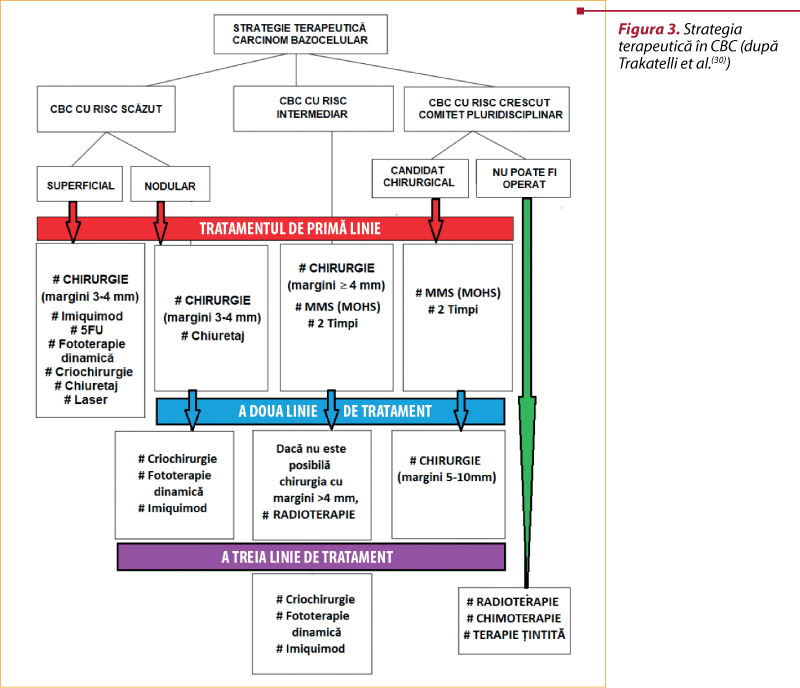
# Chirurgia. Tratamentul standard pentru toate cazurile de CBC este excizia chirurgicală, cu margini de rezecţie în ţesut sănătos. Acestea depind de caracteristicile tumorii şi de anatomia locală şi permit evaluarea histologică a radicalităţii. Dimensiunea tumorii este esenţială: pentru leziuni sub 2 cm, marginile trebuie să fie de cel puţin 4 mm pentru a îndepărta celulele tumorale în 95% din cazuri(30,32). În situaţiile dificile, cu tumori de dimensiuni mari şi/sau pe zone cu risc crescut de recidivă, rezecţia trebuie să se practice cu o margine liberă de cel puţin 3 mm(33). La tumorile cu risc intermediar sau crescut, marginile vor depăşi 4 mm, ajungând şi la 5-10 mm(30).
Astfel, tumorile care au o evoluţie îndelungată pot necesita excizii largi şi tehnici reconstructive complexe. De aici, importanţa diagnosticului şi a tratamentului precoce.
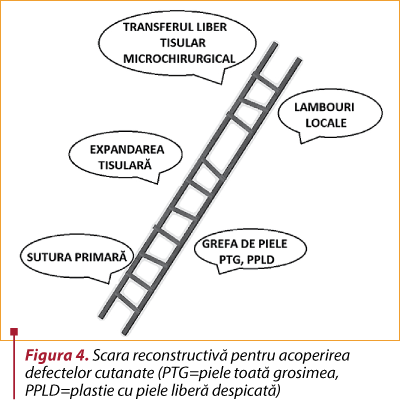
Deşi pentru acoperirea defectelor rezultate chirurgul plastician are la dispoziţie multiple variante de reconstrucţie – de dificultate crescândă, pe aşa-numita „scară reconstructivă” (figura 4) –, aceste tehnici presupun prelungirea intervenţiei şi a spitalizării, cu riscuri suplimentare şi morbiditate crescută pentru pacient.
# MMS=Mohs micrographic surgery (chirurgia Mohs) reprezintă standardul de aur pentru tumorile agresive în zonele sensibile din punct de vedere cosmetic, combinând excizia chirurgicală cu examinarea la microscop. Ţesutul excizat este congelat şi secţionat, iar examenul histopatologic extemporaneu verifică existenţa celulelor tumorale (margini pozitive sau negative, adică prezentând sau nu celule maligne). Examinarea completă a marginilor în MMS permite cea mai ridicată rată de vindecare, în acelaşi timp conservând cea mai mare cantitate de ţesut sănătos. Conservarea acestuia este importantă din punct de vedere funcţional, estetic şi reconstructiv, mai ales în cancerele localizate periorbital, lângă nas, buze, urechi, degete şi în regiunea anogenitală(27).
Recidivele CBC apar la luni sau ani după tratamentul iniţial, fiind asociate cu distrugerea importantă a ţesuturilor, cu morbiditate crescută şi risc de metastazare. În cazurile localizate în zonele cu risc ridicat sunt necesare tehnici chirurgicale de tipul MMS şi excizii seriate (doi timpi), realizate de preferinţă în centre medicale specializate şi competente.
Eficienţa mai mare a chirurgiei Mohs comparativ cu a chirurgiei tradiţionale pentru tratamentul CBC recidivate şi cu risc crescut de recidivă a fost dovedită de mai multe studii(27,31,34-36).
Îndepărtatea celulelor tumorale, cu margini negative de excizie, reprezintă principalul avantaj al metodelor chirurgicale de tratament. Metodele conservative (chiuretajul şi electrodesicaţia, criochirurgia, fototerapia dinamică, laserul CO2) şi cele medicale: topice (imiquimod şi 5 FU), radio- şi chimioterapia, deşi au în general rezultate cosmetice bune, au ca principal dezavantaj lipsa controlului histologic al eficienţei tratamentului şi radicalităţii.
# Chiuretajul şi electrodesicaţia sunt folosite pentru tumorile friabile, fără componentă fibroasă (nu pentru tipurile morfeiform, infiltrativ, micronodular sau tumori recidivate)(30). Sunt utilizate chiurete de diferite mărimi şi un electrocauter pentru îndepărtarea ţesutului tumoral.
# Criochirurgia induce necroza selectivă prin materiale criogenice – azotul lichid la -50-60°C este aplicat 20 de secunde pe leziune (care poate fi chiuretată anterior pentru a-i reduce volumul).
# Laserul CO2 este utilizat rar, la pacienţii cu diateze hemoragice, având rezultate variabile(30).
# Fototerapia dinamică foloseşte un medicament activator (ALA=acid 5-aminolevulinic, aplicat sub pansament ocluziv timp de 4-6 ore, sau esterul lui, MAL=metil-aminolevulinat, timp de 3 ore) şi apoi iluminarea cu lumină roşie de 570-670 nm, 75 J/cm2, repetată la 7 zile. Se poate folosi în CBC primar superficial (eventual, CBC nodular subţire) la pacienţii cu leziuni extinse sau multiple şi la imunodeprimaţi(30).
# 5 fluorouracilul (5FU) este utilizat pe larg pentru keratoza actinică şi carcinomul spinocelular in situ. Un studiu randomizat(37) descrie rezultatele similare ale 5FU (utilizat de două ori pe zi, timp de 4 săptămâni) cu ale fototerapiei dinamice (două sesiuni la o săptămână) şi ale imiquimodului, pentru CBC superficiale.
# Imiquimod, folosit de 5 ori pe săptămână timp de 6-12 săptămâni, este tratamentul acceptat în UE şi SUA pentru CBC superficial, sub 2 cm în diametru, la nivelul gâtului, trunchiului şi extremităţilor (excepţie sunt mâinile şi picioarele), la adulţii imunocompetenţi(30). Reacţii locale: eroziuni, ulceraţii, induraţii şi dureri, care apar la majoritatea pacienţilor.
# Radioterapia este indicată pentru pacienţii care refuză sau care nu pot tolera intervenţia chirurgicală din cauza comorbidităţilor, pentru cei cu speranţă de viaţă redusă(38,39), precum şi în cazurile cu invazie perineurală(40), cu extensie cartilaginoasă sau osoasă(41), în formele agresive, recidivate sau când există reziduu microscopic al bolii şi nu poate fi reoperat. Radioterapia este contraindicată la cazurile recidivate după iradiere şi la pacienţii cu boli genetice: sindrom Gorlin (sindromul carcinomului nevic al celulelor bazale), xeroderma pigmentosum, boli ale ţesutului conjunctiv (lupus, sclerodermie)(42).
# Chimioterapia a fost folosită pentru CBC avansat local sau metastazat. Deşi extrem de rar, CBC metastatic este extrem de fatal (supravieţuire medie de 8 luni)(43,44). Nu există tratament standard şi cazurile tratate sunt rare; sărurile de platină (cisplatin) ar putea fi utilizate, dar nefro- şi medulotoxicitatea acestora sunt periculoase pentru pacienţii în vârstă(30).
# Terapia ţintită este recent introdusă în arsenalul terapeutic. Vismodegid, inhibitor SMO, s-a dovedit eficient în CBC avansat local sau metastatic şi la cei cu mutaţii ale genei PTCH1(30).
Supravegherea pacienţilor cu CBC
Tumorile aflate pe zonele vizibile, considerate sensibile din punct de vedere cosmetic, necesită o atenţie specială pentru alegerea opţiunii terapeutice. În plus, leziunile localizate în apropierea orbitei, narinelor, cavităţii bucale şi pavilionului auricular pot determina în evoluţie sau după excizia în limite de siguranţă oncologică complicaţii stenozante ale zonelor orificiale.

Toţi pacienţii cu CBC trebuie instruiţi asupra măsurilor de protecţie solară, a importanţei autoexaminării şi a riscului apariţiei de noi leziuni. În mod ideal, pacienţii cu CBC trebuie monitorizaţi pe toată durata vieţii. Cum aşa ceva este greu de realizat, este necesar un control la fiecare 6-12 luni, timp de 3-5 ani, cel puţin pentru pacienţii cu risc crescut de recidivă, cei care au recidivat şi pentru cei cu leziuni multiple(30).
CBC avansat local şi mai ales cel metastatic necesită managementul unei echipe multidisciplinare (dermatolog, chirurg plastician, ortoped, chirurg bucomaxilofacial, radioterapeut, oncolog medical, medic de familie, psiholog) şi monitorizare atentă, individualizată.
Medicii de familie deţin un rol-cheie în depistarea cancerului cutanat, identificând leziunile suspecte şi urgentând consultul de specialitate (de chirurgie plastică şi dermatologie), constituind astfel legătura între diferitele specialităţi şi pacient.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Wu PA. Epidemiology, pathogenesis, and clinical features of basal cell carcinoma UpToDate - last updated, Aug, 26, 2019, accesat în 06/11/2020.
- Betti R, Radaelli G, Mussino F, Menni S, Crosti C. Anatomic location and histopathologic subtype of basal cell carcinomas in adults younger than 40 or 90 and older: any difference? Dermatol Surg. 2009 Feb.35(2):201-6.
- Griffin JR, Cohen PR, Tschen JA, Mullans EA, Schulze KE, Martinelli PT, Nelson BR. Basal cell carcinoma in childhood: case report and literature review. J Am Acad Dermatol. 2007 Nov. 57(5 Suppl):S97-102.
- Hannuksela-Svahn A, Pukkala E, Karvonen J. Basal cell skin carcinoma and other nonmelanoma skin cancers in Finland from 1956 through 1995. Arch Dermatol. 1999;135:781.
- Chuang TY, Popescu A, Su WP, Chute CG. Basal cell carcinoma. A population-based incidence study in Rochester, Minnesota. J Am Acad Dermatol. 1990;22:413.
- Green A, Battistutta D, Hart V, Leslie D, Weedon D. Skin cancer in a subtropical Australian population: incidence and lack of association with occupation. The Nambour Study Group. Am J Epidemiol. 1996;144:1034-40.
- Marks R, Staples M, Giles GG. Trends in non-melanocytic skin cancer treated in Australia: the second national survey. Int J Cancer. 1993;53:585.
- Bader RS. Basal cell carcinoma, Medscape, updated 02/03/2020, accesat la data de 05/11/2020 pe https://emedicine.medscape.com/article/276624-overview.
- Niall W, Kirkpatrick A, Miller MC C, Nanchahal J. Skin and its appendages, Chapter 7. Section 1, Gray’s Anatomy The Anatomical Basis of Clinical Practice - Fortieth Edition, Elsevier, 2008, p. 145.
- Ng E, Kauvar A. Basal cell carcinoma - Plastic Surgery Key. Accesat la https://plasticsurgerykey.com/basal-cell-carcinoma-6/ la 07/11/2020.
- Olsen CM, Wilson LF, Green AC, Bain CJ, Fritschi L, Neale RE, Whiteman DC. Cancers in Australia Attributable to Exposure to Solar Ultraviolet Radiation and Prevented by Regular Sunscreen Use. Aust N Z J Public Health. 2015;39,471-476.
- Fitzpatrick TB. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol. 1988 Jun;124(6): 869-71.
- Khalesi M, Whiteman DC, Tran B, Kimlin MG, Olsen CM, Neale RE. A meta-analysis of pigmentary characteristics, sun sensitivity, freckling and melanocytic nevi and risk of basal cell carcinoma of the skin. Cancer Epidemiol. 2013;37:534.
- Vitasa BC, Taylor HR, Strickland PT, Rosenthal FS, West S, Abbey H, Ng SK, Munoz B, Emmett EA. Association of nonmelanoma skin cancer and actinic keratosis with cumulative solar ultraviolet exposure in Maryland watermen. Cancer. 1990;65:2811.
- van Dam RM, Huang Z, Rimm EB, Weinstock MA, Spiegelman D, Colditz GA, Willett WC, Giovannucci E. Risk factors for basal cell carcinoma of the skin in men: results from the health professionals follow-up study. Am J Epidemiol. 1999;150:459.
- Zanetti R, Rosso S, Martinez C, Nieto A, Miranda A, Mercier M, Loria DI,Østerlind A, Greinert R, Navarro C, Fabbrocini G, Barbera C, Sancho-Garnier H, Gafà L, Chiarugi A, Mossotti R. Comparison of risk patterns in carcinoma and melanoma of the skin in men: a multi-centre case-case-control study. Br J Cancer. 2006;94:743.
- Kricker A, Armstrong BK, English DR, Heenan PJ. Does intermittent sun exposure cause basal cell carcinoma? A case-control study in Western Australia. Int J Cancer. 1995;60:489.
- Wehner MR, Shive ML, Chren MM, Han J, Qureshi AA, Linos E. Indoor tanning and non-melanoma skin cancer: systematic review and meta-analysis. BMJ. 2012;345:e5909.
- Stern RS, Liebman EJ, Väkevä L. Oral psoralen and ultraviolet – A light (PUVA) treatment of psoriasis and persistent risk of nonmelanoma skin cancer. PUVA Follow-up Study. J Natl Cancer Inst. 1998;90:1278.
- Levi F, Moeckli R, Randimbison L, Te VC, Maspoli M, La Vecchia C. Skin cancer in survivors of childhood and adolescent cancer. Eur J Cancer. 2006;42:656.
- Watt TC, Inskip PD, Stratton K, Smith SA, Kry SF, Sigurdson AJ, Stovall M, Leisenring W, Robison LL, Mertens AC. Radiation-related risk of basal cell carcinoma: a report from the Childhood Cancer Survivor Study. J Natl Cancer Inst. 2012;104:1240.
- Robinson JK. Risk of developing another basal cell carcinoma. A 5-year prospective study. Cancer. 1987;60:118.
- Karagas MR, Stukel TA, Greenberg ER, Baron JA, Mott LA, Stern RS. Risk of subsequent basal cell carcinoma and squamous cell carcinoma of the skin among patients with prior skin cancer. Skin Cancer Prevention Study Group. JAMA. 1992;267:3305.
- Slater D, Walsh M. Dataset for the histological reporting of primary cutaneous basal cell carcinoma. Standards and datasets for reporting cancers. The Royal College of Pathologist, London. May 2014. https://www.rcpath.org/resourceLibrary/g123-data-set-basal-may-2014.html
- Tomas S. Early detection and non-invasive diagnosis of basal cell carcinoma using dermatoscope. Aust Fam Physician. 2015 Sep;44(9):660-2.
- Reiter O, Mimouni I, Gdalevich M, Marghoob AA, Levi A, Hodak E, Leshem YA. The diagnostic accuracy of dermoscopy for basal cell carcinoma: A systematic review and meta-analysis. J Am Acad Dermatol. 2019;80:1380.
- Lam C, Poblete-Lopez C, Billingsley M Mohs Micrographic Surgery’s role in the treatment of skin Cancer – Plastic Surgery Key. Accesat la https://plasticsurgerykey.com/mohs-micrographic-surgerys-role-in-the-treatment-of-skin-cancer/ la 07/11/2020.
- Alexandroff A. Melanoma. Accesat la https://www.bupa.co.uk/health-information/cancer/melanoma la data de 05/11/2020.
- Dandurand M, Petit T, Martel P, Guillot B. Management of basal cell carcinoma in adults: Clinical practice guidelines. Eur J Dermatol. 2006;16:394-401.
- Trakatelli M, Morton C, Nagore E, Ulrich C, Del Marmol V, Peris K, Basset-Seguin N. BCC subcommittee of the Guidelines Committee of the European Dermatology Forum. Update of the European guidelines for basal cell carcinoma management. Eur J Dermatol. 2014 May-Jun;24(3):312-29.
- Aasi SZ. Treatment of basal cell carcinomas at high risk for recurrence. UpToDate - last updated Febr 3, 2020. Accesat în 06/11/2020.
- Wolf DJ, Zitelli JA. Surgical margins for basal cell carcinoma. Arch Dermatol. 1987;123:340-4.
- Gulleth Y, Goldberg N, Silverman RP, Gastman BR. What is the best surgical margin for a Basal cell carcinoma: a meta-analysis of the literature. Plast Reconstr Surg. 2010 Oct;126(4):1222-31.
- Smeets NWJ, Krekels GAM, Ostertag JU, Essers BAB, Dirksen CD, Nieman FHM, Neumann HAM. Surgical excision versus Mohs’ micrographic surgery for basal-cell carcinoma of the face: randomized controlled trial. Lancet. 2004;364:1766-72.
- Mosterd K, Krekels GAM, Nieman FHM, Ostertag JU, Essers BAB, Dirksen CD, Steijlen PM, Vermeulen A, Neumann H, Kelleners-Smeets NWJ. Surgical excision versus Mohs’ micrographic surgery forprimary and recurrent basal-cell carcinoma of the face: A prospective randomized controlled trial with 5-years’ follow-up. Lancet Oncology. 2008;9:1149-56.
- van Loo E, Mosterd K, Krekels GAM, Roozeboom MH, Ostertag JU, Dirksen CD, Steijlen PM, Neumann HAM, Nelemans PJ, Kelleners-Smeets NWJ. Surgical excision versus Mohs’ micrographic surgery for basal-cell carcinoma of the face: A randomized clinical trial with 10 years follow-up. European Journal of Cancer. 2014;50,3011-3020.
- Arits AHMM, Mosterd K, Essers BAB, Spoorenberg E, Sommer A, De Rooij MJD, van Pelt HPA, Quaedvlieg PJF, Krekels GAM, van Neer PAFA, Rijzewijk JJ, van Geest AJ, Steijlen PM, Nelemans PJ, Kelleners-Smeets PWJ. Photodynamic therapy versus topical imiquimod versus topical fluorouracil for treatment of superficial basal-cell carcinoma: a single blind, non-inferiority randomised controlled trial. Lancet Oncol. 2013 Jun;14(7):647-54.
- Russi EG, Pelissero A, Melano A, Fillini C, Vigna-Taglianti R, Gianello L, Lucio F, Settineri N, Santacaterina A, Pontoriero A, Iatì G, Pergolizzi S. Facial Basal Cell Carcinomas in Elderly Frail Patients Treated with Low Total-dose Radiotherapy. Anticancer Res. 2015;35: 4949-53.
- Pelissero A, Russi EG, Melano A, Fillini C, Vigna-Taglianti R, Settineri N, Lucio F, Girolomoni G, Pergolizzi S. Facial basal cell carcinomas treated with hypo-fractionated radiotherapy: A retrospective analysis in 117 elderly patients. J Am Acad Dermatol. 2015;73:166-8.
- Santos AB, Andrade NM, Brandão LG, Cernea CR. Which features of advanced head and neck basal cell carcinoma are associated with perineural invasion? Braz J Otorhinolaryngol. 2016.doi:10.1016/j.bjorl.2016.01.009. In press.
- Fort M, Guet S, Colson-Durand L, Auzolle C, Belkacemi Y. Role of radiation therapy in non-melanoma cancers, lymphomas and sarcomas of the skin: Systematic review and best practice in 2016. Crit Rev Oncol Hematol. 2016;99:200-13.
- Voss N, Kim-Sing C. Radiotherapy in the treatment of dermatologic malignancies. Dermatol Clin. 1998;16:313-320.
- Wadhera A, Fazio M, Bricca G, Stanton O. Metastatic basalcell carcinoma: a case report and literature review. How accurate is our incidence data? Dermatol Online J. 2006;12:7.
- Raszewski RL, Guyuron B. Long-term survival following nodal metastases from basal cell carcinoma. Ann Plast Surg. 1990;24:170-5.
Articole din ediţiile anterioare
Rolul medicului de familie în creşterea şanselor de supravieţuire în cancerul pulmonar
Introducere. Cancerul pulmonar, una dintre cele mai comune şi letale forme de cancer la nivel mondial, este influenţat de factori precum fumatul şi...
Aspecte actuale în profilaxia primară a bolilor cardiovasculare
Determinanţii sociali sunt cei mai importanţi markeri ai stării de sănătate. Identificarea factorilor de risc şi intervenţia standardizată asupr...
Dermatita atopică
Dermatita atopică este o boală inflamatorie cutanată cronică, asociată cu prurit intens, care apare cel mai frecvent la copii. În principal, factor...
Argumente pentru integrarea factorilor de risc profesional în evaluarea riscului de sindrom metabolic
Prevenţia sindromului metabolic a devenit una din cele mai însemnate provocări ale medicinei actuale. Consecinţă directă a creşterii incidenţei obe...