Asthma is the most common chronic illness of the child, a frequent cause of hospitalization and morbidity in pediatrics. Symptomatology control is the therapeutic target, and the practitioner has to adapt the treatment recommendations to each case, with its own clinical and evolutionary particularities. Omalizumab is a humanized anti-human immunoglobulin E (human IgG) recombinant monoclonal antibody used in the treatment of asthma in children over 12 years of age. The authors exemplify the benefit of omalizumab in the management of asthma by presenting a clinical case.
Astm bronşic de treapta III sub tratament cu omalizumab. Prezentare de caz
Moderate-persistent asthma in children – omalizumab benefits. Case presentation
First published: 28 martie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.53.1.2019.2352
Abstract
Rezumat
Astmul bronşic este cea mai frecventă boală cronică a copilului, reprezentând o cauză frecventă de spitalizare şi morbiditate în pediatrie. Controlul simptomatologiei reprezintă ţinta terapeutică, iar practicianul trebuie să adapteze recomandările la fiecare caz, cu particularităţile sale clinice şi evolutive. Omalizumab este un anticorp monoclonal recombinant umanizat antiimunoglobulină E umană (IgE), utilizat în tratamentul astmului bronşic la copiii de peste 12 ani. Autorii exemplifică prin prezentarea unui caz clinic beneficiul omalizumabului în managementul astmului bronşic.
Astmul bronşic reprezintă o patologie complexă, caracterizată prin inflamaţia cronică a căilor respiratorii. Acesta implică un istoric de simptome respiratorii precum wheezing, dispnee, senzaţie de constricţie toracică şi tuse, simptomatologie care variază ca durată şi ca intensitate, precum şi o obstrucţie variabilă a căilor respiratorii. Acestea pot avea remisiune spontană sau în urma tratamentului şi pot fi absente timp de săptămâni sau luni. Hiperreactivitatea bronşică şi inflamaţia cronică a căilor respiratorii pot persista chiar şi în absenţa simptomatologiei sau în cazul unei funcţii ventilatorii normale, dar pot fi controlate prin tratament. Astmul alergic reprezintă cea mai comună formă, asociată cu un istoric familial şi/sau personal de boli alergice (rinită alergică, urticarie alergică, alergii alimentare sau medicamentoase).
Astmul alergic (IgE mediat) moderat spre sever, la care nu se obţine un bun control prin tratament corticoterapic inhalator, poate beneficia de tratament biologic. Omalizumab este un anticorp monoclonal recombinant umanizat antiimunoglobulină E umană (IgE), care leagă cu mare afinitate fragmentul Fc al moleculei de IgE (acelaşi care în mod natural se leagă de FcRI), scăzând concentraţia IgE cu până la 99% în doar câteva ore. De asemenea, acesta determină şi diminuarea receptorilor FcRI de pe mastocite, bazofile, monocite şi celule prezentatoare de antigen, în decurs de 8-12 săptămâni, prevenind pe aceste căi degranularea mastocitară şi toate consecinţele sale. În tratamentul pacienţilor cu astm bronşic alergic, omalizumab determină scăderea numărului de exacerbări per pacient şi scăderea dozei de corticosteroid inhalator necesară unui control bun al bolii(1,2).
Prezentăm cazul unei paciente în vârstă de 16 ani, din mediul rural, aflată în evidenţă cu diagnosticul de astm bronşic alergic treapta III, pentru care urmează tratament cu omalizumab (Xolair® 600 mg/lună), care se adresează pentru următoarele acuze: dispnee progresivă, wheezing, tuse, stare generală alterată, simptomatologie care a debutat în urmă cu aproximativ două săptămâni de la internare, în urma expunerii de aproximativ două săptămâni la mucegai, şi care nu a prezentat ameliorare în urma tratamentului antibiotic, bronhodilatator şi corticosteroid sistemic iniţiat în timpul internării la Spitalul Municipal de Urgenţă din Roman, motiv pentru care s-a hotărât transferul în Clinica II Pediatrie – Spitalul Clinic de Urgenţă pentru Copii „Sf. Maria”, Iaşi.
Din antecedentele heredocolaterale reţinem că mama a fost diagnosticată cu hipertensiune arterială esenţială, iar tatăl şi sora sunt aparent sănătoşi; de asemenea, pacienta neagă contactul cu persoane cu afecţiuni infecto-contagioase şi tuberculoză.
Antecedentele personale patologice relevă astm bronşic treapta III, diagnosticat la vârsta de 14 ani, cu numeroase exacerbări, care au necesitat spitalizări repetate în cadrul Spitalului de Urgenţă din Roman, precum şi hipersensibilizare la diverşi pneumoalergeni (acarieni din praful de casă, mucegai), trofoalergeni (alune, morcov, cartof, gluten), confirmată prin efectuarea unui panel, şi la ceftriaxonă. Ea se afla în evidenţa Clinicii II Pediatrie Iaşi din august 2018, când s-a adresat pentru o criză severă de astm.
Pacienta îndeplinea criteriile de eligibilitate pentru includerea în tratamentul biologic cu anticorpi monoclonali anti-IgE (omalizumab): vârsta peste 12 ani, diagnostic de astm documentat de peste un an, alergie IgE mediată confirmată prin IgE specifice prezente la un aeroalergen peren – în acest caz, acarienii din praful de casă, tratament cu corticosteroizi inhalatori în doză mare, în asociere cu beta-2 agonist cu durată lungă de acţiune timp de minimum 6 luni, conform recomandărilor GINA, excluderea altor boli care pot mima astmul bronşic, lipsa de control a astmului (scor simptomatic ACT <20). Pe baza nivelului seric al IgE totale de 702 UI/mL şi a greutăţii pacientei de 65 kg, s-a stabilit protocolul terapeutic – 300 mg omalizumab la două săptămâni, conform indicaţiilor ghidului. Pacienta a primit prima doză de omalizumab în septembrie 2018, cu patru luni anterior internării curente, fără incidente. După a doua doză de omalizumab, administrată tot în cadrul clinicii noastre, pacienta a primit tratament şi a fost monitorizată în teritoriu, din motive personale de natură socioeconomică, fără incidente, cu reducerea numărului de exacerbări şi creşterea calităţii vieţii în timpul celor 4 luni de tratament.
În ceea ce priveşte condiţiile de viaţă şi comportamentul faţă de mediu, reţinem că pacienta locuieşte în mediul rural, la casă, ocazional în casa bunicilor, unde există expunere la mucegai; contact cu animale domestice (câine şi pisică); nefumătoare, dar prezintă expunere pasivă la fum de ţigară.
Medicaţia de fond administrată anterior internării este reprezentată de corticosteroid inhalator – propionat de fluticazonă 500 µg 1 puf x 2/zi, antagonist al receptorului pentru leukotriene – montelukast 10 mg/zi, anticorpi monoclonali anti-IgE – omalizumab 300 mg la două săptămâni. În timpul spitalizării în cadrul spitalului din Roman s-a administrat tratament antibiotic bronhodilatator şi corticosteroid sistemic.
Examenul clinic efectuat la internare relevă: stare generală moderat influenţată, conştientă, cooperantă, afebrilă, talia de 167 cm, greutatea de 60 kg, IMC = 21,5 kg/m²; tegumente palide, elastice, calde; examenul aparatului respirator obiectivează: wheezing, expir prelungit, tiraj generalizat, auscultător – raluri ronflante şi sibilante la nivelul ambelor arii pulmonare, SpO2 = 93% în aerul ambiental. În rest, TA = 110/60 mmHg, FC = 111 bătăi pe minut, zgomote cardiace ritmice, abdomen suplu, nedureros, declarativ – două scaune/zi, semiconsistente în ultimele zile anterior internării.
Biologic, decelăm următoarele modificări patologice: hemoleucogramă cu neutrofilie şi limfopenie, anemie hipocromă uşoară, sindrom inflamator nespecific (VSH = 79 mm/1 h, fibrinogen = 618 mg/dl, CRP = 31 mg/L), nivel seric IgE totale crescut (3287 UI/ml). Examenul microbiologic al sputei arată prezenţa Streptococcus pneumoniae.
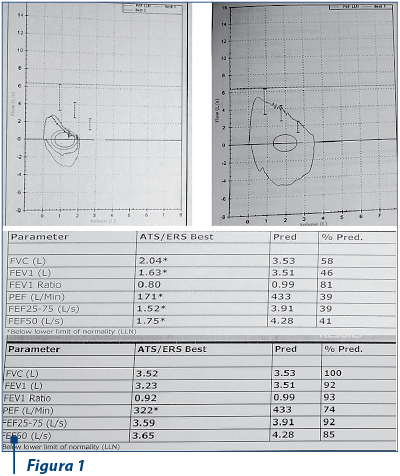
Probele funcţionale respiratorii evidenţiază disfuncţie ventilatorie obstructivă, cu reversibilitate de 31% după administrarea de bronhodilatator (figura 1).
Electrocardiograma arată ritm sinusal cu o frecvenţă cardiacă de 62 bătăi/minut, axa QRS intermediară, morfologie normală a complexelor.
Radiografia toracică efectuată la internare relevă desen pulmonar accentuat bilateral, cu aspect reticulat, sinusuri costodiafragmatice libere; cord, mediastin normale radiologic.
Din cauza persistenţei simptomatologiei, în ciuda tratamentului efectuat, se efectuează CT toracic, care descrie: la nivelul segmentelor bazale ale lobului inferior stâng, numeroase opacităţi micronodulare şi de dimensiuni mai mari, unele confluate, cu aspect de „geam mat” şi „arbore înmugurit” perilezional (care sugerează afectare alveolară şi bronşiolară), bronşii segmentare cu pereţi îngroşaţi, neregulaţi, calibru redus comparativ cu hemitoracele drept, cu secreţii în interior, îngroşarea septurilor interlobulare, lob inferior stâng cu scăderea în ansamblu a radiotransparenţei şi a dimensiunilor (hipoaerat), absenţa revărsatului lichidian pleuro-pericardic, absenţa adenopatiilor mediastinale decelabile pe examinarea nativă, schelet toracic cu aspect CT în limite normale.
Se solicită consult pneumoftiziologic pentru investigarea suspiciunii de tuberculoză pulmonară, fiind recomandată efectuarea testelor IDR şi QuantiFERON, care au fost negative.
Pe parcursul internării a urmat tratament antibiotic, glucocorticoid, tratament adjuvant corticoterapiei şi antihistaminic, cu evoluţie clinică lent favorabilă. Se externează cu stare generală ameliorată, fără semne de insuficienţă respiratorie şi cu următoarele recomandări: tratament antibiotic la domiciliu conform antibiogramei (amoxicilină + acid clavulanic), continuă tratamentul cronic cu: corticosteroid inhalator (propionat de fluticazonă), antagonist al receptorului pentru leukotriene (montelukast), antihistaminic (desloratadină) şi omalizumab în doză de 225 mg la două săptămâni; vaccinare antipneumococică o dată la 5 ani; măsuri de evicţie a alergenului.
Particularitatea cazului este reprezentată de nivelul crescut al IgE serice totale (3287 UI/ml – interval normal 0-100 UI/ml) la 4 luni de la iniţierea tratamentului anti-IgE. Numeroase studii au raportat o scădere a nivelului de IgE circulante la pacienţii aflaţi sub tratament. Mai mult, s-au observat scăderi ale IgE şi la pacienţii care nu au răspuns la omalizumab, iar din această cauză, valorile IgE circulante nu pot fi utilizate ca marker al răspunsului la tratament(1).
Omalizumab reprezintă un ansamblu uman IgG1 kappa care conţine 5% regiuni determinante de complementaritate (CDR) în anticorp murin (MW ~150kD) (figura 2).

Indicaţiile omalizumabului în tratamentul la copil (Congresul European Respiratory Society de la Viena din 2009) sunt următoarele: terapie „add-on” pentru îmbunătăţirea controlului astmului la pacienţi ≥6 ani, astm alergic sever persistent, teste cutanate pozitive la aeroalergene perene, simptome diurne sau nocturne frecvente, exacerbări severe frecvente sub corticosteroizi inhalatori (CSI) în doze mari, în asociere cu 2-agonişti cu acţiune de lungă durată (BALD), prezenţa funcţiilor pulmonare diminuate la pacienţii cu vârsta de peste 12 ani.
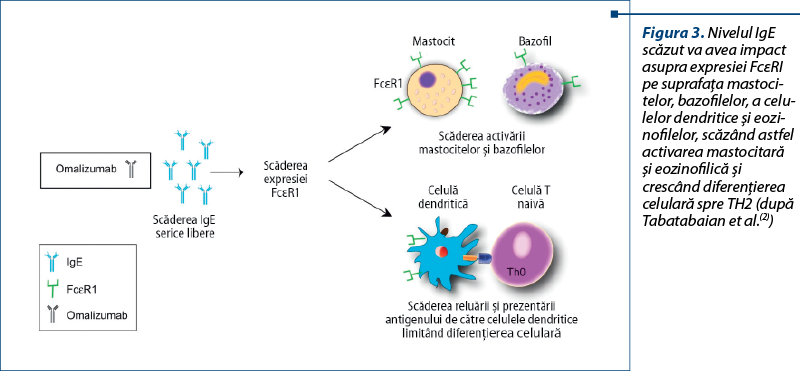
Ca mecanism de acţiune, omalizumab (anticorp monoclonal anti-IgE) captează şi reduce rapid IgE libere din circulaţie (aproape 99% în câteva ore), eliminându-le prin sistemul reticuloendotelial. Prin această acţiune reuşeşte să scadă depunerea IgE pe receptorii celulari. Celulele efectoare (mastocitele) nu mai recunosc alergenul, iar degranularea mastocitară şi consecinţele acesteia sunt evitate. Deoarece omalizumab nu se leagă de moleculele IgE deja ataşate la receptor, efectul anafilactogen al acestui anticorp monoclonal este minim (figura 3).
Studiile publicate în literatura de specialitate atestă faptul că tratamentul de lungă durată cu omalizumab (la pacienţi urmăriţi şi trataţi pe parcursul a şase ani) continuă să reducă simptomele de astm şi markerii imunologici şi după trei ani de la întreruperea administrării (Nopp A et al., 2007). La trei ani după stoparea tratamentului cu omalizumab, 12 din cei 18 pacienţi incluşi în studiu prezentau simptome ameliorate sau nu mai erau simptomatici. Cei mai mulţi dintre ei, respectiv 16 din cei 18, nu au mai declarat crize nocturne, iar 14 dintre aceştia nu au necesitat ajustarea dozelor de medicaţie controller. Astfel, majoritatea pacienţilor incluşi în respectivul studiu au menţinut un nivel controlat al simptomelor la trei ani după terminarea terapiei de şase ani cu omalizumab(3).
Răspunsul terapeutic la omalizumab în astmul alergic se obţine în 60-70% dintre cazuri, devenind aparent după 12-16 săptămâni de tratament. Nu există o corelaţie strictă între severitatea astmului şi nivelurile de IgE(4) şi nu există criterii ferme care să permită predicţia răspunsului terapeutic la omalizumab. Datele extrase din şapte studii randomizate au arătat că nu există suficiente dovezi care să ateste rolul predictiv al nivelului IgE total privind răspunsul la tratamentul cu omalizumab la pacienţii astmatici. S-au obţinut valori oscilante ale IgE, unele dintre acestea neconcordante cu răspunsul clinic şi terapeutic, motiv pentru care autorii recomandă datele clinice şi examenul clinic (la minimum 16 săptămâni de la iniţierea terapiei) ca modalităţi de evaluare a răspunsului la tratament.
Spre deosebire de concentraţia de IgE circulante, IgE totale (IgE totale şi complexele IgE-omalizumab) vor prezenta valori crescute (în medie, de 2-5 ori mai mari faţă de limita superioară a intervalului normal) prin clearance-ul încetinit al complexelor IgE-Ac anti-IgE(5).
O explicaţie a creşterii nivelului seric al IgE poate fi prelungirea timpului de înjumătăţire a imunoglobulinei E libere prin formarea complexului IgE-Ac anti-IgE: timpul de înjumătăţire pentru IgE este de două-trei zile, iar timpul de înjumătăţire pentru Ac anti-IgE (din clasa IgG1) este de 26 de zile(6). Alte studii pediatrice arată că însăşi expunerea la mucegai ar duce la o creştere a nivelului seric de IgE totale, prin stimularea producerii de IgE, chiar şi la copiii care nu prezintă IgE specifice antimucegai(7).
Există numeroase studii care atestă siguranţa şi eficienţa tratamentului cu anticorpi monoclonali anti-IgE (omalizumab), trialuri clinice desfăşurate pe durate medii (minimum un an) care înglobează aproximativ 7500 de pacienţi cu astm bronşic ori rinită alergică sau pe durată de patru ani, în cazul celor diagnosticaţi cu astm bronşic sever(8). S-au analizat riscurile privind afectarea sistemului imunitar, reacţiile de hipersensibilitate, neoplaziile, malignităţile, infecţiile şi discraziile sangvine precum trombocitopenia. Rezultatele indică un bun profil de siguranţă şi toleranţă al omalizumabului, menţinut pe parcursul celor patru ani de studiu. Incidenţa anafilaxiei a fost de 0,14% în cazul pacienţilor trataţi cu omalizumab şi de 0,07% în cazul pacienţilor din lotul de control. Niciun pacient inclus în studiu nu a sintetizat anticorpi anti-omalizumab la titruri măsurabile. De asemenea, nu au fost citate răspunsuri imune aberante în timpul şi după terminarea studiului şi nici risc crescut de malignităţi datorate tratamentului cu omalizumab. În concluzie, la pacienţii cu astm alergic moderat-sever sau sever, tratamentul cu anticorpi monoclonali anti-IgE (omalizumab) prezintă un profil înalt de siguranţă, eficienţă şi toleranţă(8).
Aşadar, trebuie luată în discuţie oportunitatea introducerii terapiei cu anticorpi anti-IgE la pacienţii pediatrici cu astm bronşic alergic moderat-sever sau sever, la care medicaţia controller nu reuşeşte să prevină exacerbările. În cadrul terapiei trebuie monitorizat răspunsul clinic şi biologic la tratament, prin controale regulate, care implică o complianţă crescută din partea pacientului şi a aparţinătorilor. Profilul ridicat de eficienţă şi siguranţă garantat de studiile efectuate recomandă omalizumabul ca terapie de viitor în astmul bronşic şi în comorbidităţile alergice la copil.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Lowe PJ, Tannenbaum S et al. Relationship between omalizumab pharmacokinetics, IgE pharmacodynamics and symptoms în patients with severe persistent allergic (IgE-mediated) asthma. Br J Clin Pharmacol. 2009;68(1):61–76.
- Tabatabaian F, Ledford DK. Omalizumab for severe asthma: toward personalized treatment based on biomarker profile and clinical history. Dovepress. April 2018 Volume 2018:11 Pages 53-61.
- Nopp A et al. After 6 years with Xolair; a 3-year withdrawal follow-up. Allergy. 2010 Jan;65(1):56-60. doi: 10.1111/j.1398-9995.2009.02144.x. Epub 2009 Oct 1.
- Bousquet J1, Rabe K, Humbert M, Chung KF, Berger W, Fox H, Ayre G, Chen H, Thomas K, Blogg M, Holgate S. Predicting and evaluating response to omalizumab in patients with severe allergic asthma. Respir Med. 2007 Jul;101(7):1483-92. Epub 2007 Mar 6.
- Milgrom H, Fick RB, Su JQ, et al. Treatment of allergic asthma with monoclonal anti-IgE antibody. N Engl J Med. 1999; 341:1966-1973
- Eckl-Dorna J. Omalizumab’s Impact on Total and Allergen-Specific IgE Levels: A Polyclonal Story. Int Arch Allergy Immunol. 2016; 169:69-70.
- Su HJJ et al. Domestic exposure to fungi and total serum IgE levels in asthmatic children. Mediators of inflammation vol. 2005,3 (2005): 167-70.
- Corren J, Casale TB, Lanier B, Buhl R, Holgate S, Jimenez P. Safety and tolerability of omalizumab. Clinical and Experimental Allergy. 2009 June; Volume 39, Issue 6, 788-797.
Articole din ediţiile anterioare
Modificările ghidurilor în gastroenterologia şi endoscopia digestivă pediatrică în contextul pandemiei cu SARS-CoV-2
he infection with the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) causes the coronavirus disease 2019 (COVID-19).
Sindromul de lob mijlociu în alergia respiratorie - prezentare de caz
Sindromul de lob mijlociu este o entitate clinico-radiologică în care obstrucția parțială sau totală a lumenului bronhiei mijlocii prin procese inf...
Particularităţi clinico-biologice în purpura Henoch-Schönlein la copil
Purpura Henoch-Schönlein este cea mai frecventă vasculită imună întâlnită în populaţia pediatrică, având o incidenţă maximă la grupa de vârstă 2-8 ...
Introduction to the use of artificial intelligence in pediatrics
Inteligenţa artificială (IA) reprezintă un domeniu fascinant, care a captat atenţia oamenilor de ştiinţă şi a cercetătorilor. Definiţiile I