The concept of the „unified respiratory disease” emphasizes the close connection between the upper and lower respiratory pathways in allergic diseases. The structure and function of the upper and lower respiratory pathways are closely interconnected, forming a single morphofunctional entity. Studies show that allergic rhinitis and asthma share the same inflammatory cells and Th2-type cytokines in nasal and bronchial biopsy samples. Additionally, bronchial challenges can induce inflammation in the nasal area and vice versa, suggesting a close link between the two conditions. The epithelial barrier, through its junctions and constituent proteins, plays an essential role in maintaining homeostasis and protection against external factors, and the complex interactions between these two segments of the respiratory pathways are an important research topic. Tight junctions, adhesion junctions, gap junctions, as well as desmosomes contribute to maintaining epithelial integrity and regulating inflammation. The constituent proteins of these junctions and their interactions play crucial roles in the proper functioning of the epithelial barrier. Respiratory allergens such as dust mites, pollen, pets, and fungi are risk factors for both conditions. Recent studies have highlighted numerous environmental factors capable of compromising epithelial integrity and disrupting its barrier function, including allergens with protease activity. Allergenic proteases from various sources, such as dust mites, pollen, fungi, and kitchen cockroaches, have been identified and characterized. Studies have shown the significant role these allergens play in compromising the integrity of the respiratory epithelium and triggering allergic responses. They can activate specific receptors, inducing inflammation and disrupting the epithelium’s barrier function. For example, proteases from dust mites cleave junctional proteins, promoting allergen transport and triggering the release of proinflammatory cytokines. The same effect is observed with pollen, fungi, and kitchen cockroaches. The proteolytic activity of allergens contributes to sensitization and the progression of allergic diseases. Understanding these mechanisms can guide the development of effective therapeutic strategies for preventing and treating these conditions.
Corelaţia dintre rinita alergică şi astm
Correlation between allergic rhinitis and asthma
First published: 21 decembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.4.2023.9254
Abstract
Rezumat
Conceptul de „o singură boală a căilor respiratorii” subliniază legătura strânsă dintre căile respiratorii superioare şi inferioare în bolile alergice. Structura şi funcţia căilor respiratorii superioare şi inferioare sunt strâns interconectate, constituind o singură entitate morfofuncţională. Studiile arată că rinita alergică şi astmul au aceleaşi celule inflamatorii şi citokine de tip Th2 în probele de biopsie nazală şi bronşică. De asemenea, provocările bronşice pot induce inflamaţie la nivel nazal şi invers, sugerând o legătură strânsă între cele două afecţiuni. Bariera epitelială, prin joncţiunile sale şi proteinele componente, joacă un rol esenţial în menţinerea homeostaziei şi protejarea împotriva factorilor externi, iar interacţiunile complexe dintre aceste două segmente ale căilor respiratorii sunt un subiect important de cercetare. Joncţiunile strânse, de adeziune şi gap, precum şi desmozomii contribuie la menţinerea integrităţii epiteliale şi la reglarea inflamaţiei. Proteinele componente ale acestor joncţiuni şi interacţiunile dintre ele joacă roluri cruciale în funcţionarea adecvată a barierei epiteliale. Alergenii respiratori, precum acarienii din praful de casă, polenurile, animalele de companie şi fungii, sunt factori de risc pentru ambele afecţiuni. Studiile recente au evidenţiat numeroşi factori de mediu capabili să compromită integritatea epiteliului şi să perturbe funcţia sa de barieră, inclusiv alergenii cu activitate proteazică. Proteazele alergenice provenite de la diverse surse, precum acarienii din praful de casă, polenurile, fungii şi gândacii de bucătărie, au fost identificate şi caracterizate. Studiile au arătat rolul semnificativ pe care îl au aceşti alergeni în compromiterea integrităţii epiteliului căilor respiratorii şi în declanşarea răspunsurilor alergice. Aceştia pot activa receptori specifici, inducând inflamaţie şi perturbând funcţia de barieră a epiteliului. Proteazele provenite de la acarienii din praful de casă clivează proteinele joncţionale, favorizând transportul alergenului şi declanşând eliberarea de citokine proinflamatorii. Acelaşi efect este observat şi în cazul polenurilor, al fungilor şi al gândacilor de bucătărie. Activitatea proteolitică a alergenilor contribuie la sensibilizare şi la progresia bolilor alergice. Înţelegerea acestor mecanisme poate ghida dezvoltarea unor strategii terapeutice eficiente pentru prevenirea şi tratarea acestor afecţiuni.
Introducere
Deşi astmul şi rinita apar adesea împreună, legătura dintre cele două patologii este încă un subiect de dezbatere. Astmul şi rinita ar putea reprezenta două manifestări diferite ale aceleiaşi boli atopice, iar pe de altă parte, astmul şi rinita ar putea interacţiona între ele. Căile respiratorii superioare şi inferioare pot fi influenţate de un proces inflamator comun, menţinut şi amplificat de mecanisme înlănţuite. Aceleaşi celule inflamatorii (limfocite T, eozinofile) şi citokine de tip Th2 au fost identificate în probele de biopsie nazală şi bronşică la pacienţii cu rinită alergică şi astm. Recent s-a arătat că provocarea bronşică segmentară poate induce inflamaţie nazală la pacienţii cu rinită alergică şi, invers, provocarea nazală cu alergen poate induce inflamaţie în epiteliul bronşic. La copii, de obicei, rinita este diagnosticată mai târziu decât astmul. Cu toate acestea, studiile realizate la adulţi au arătat că rinita alergică adesea precedă dezvoltarea astmului şi s-a sugerat că rinita ar putea fi în sine un factor de risc pentru astm. Această ultimă ipoteză este deosebit de interesantă, deoarece sugerează că tratarea rinitei ar putea ajuta la prevenirea dezvoltării astmului. Studiile epidemiologice au demonstrat în mod constant că rinita alergică şi astmul coexistă adesea la acelaşi pacient, indiferent de vârstă. Aproximativ 80% dintre pacienţii diagnosticaţi cu astm prezintă rinită alergică şi aproximativ 38% dintre pacienţii cu rinită alergică prezintă şi astm (Bousquet et al., 2008; Acevedo-Prado et al., 2022). În populaţia pediatrică, aproximativ 40% dintre copiii diagnosticaţi cu rinită alergică manifestă şi astm, iar aproximativ 60% dintre copiii diagnosticaţi cu astm prezintă şi rinită alergică (Burgess et al., 2007; Pakkasela et al., 2020). Dezvoltarea astmului apare mai frecvent în rândul pacienţilor cu rinită decât în cazul celor fără rinită. Un studiu din Statele Unite ale Americii a arătat că prezenţa rinitei alergice diagnosticată de medic în copilărie este asociată independent cu dublarea riscului de dezvoltare a astmului până la vârsta de 11 ani. Într-un studiu de urmărire a studenţilor universitari, desfăşurat pe o perioadă de 23 de ani, rinita alergică a fost evidenţiată ca factor de risc pentru astm, constatare confirmată ulterior de alte cercetări. 10,5% dintre studenţii diagnosticaţi iniţial cu rinită alergică au dezvoltat ulterior astm, comparativ cu 3,6% dintre cei care nu au prezentat rinită. În ambele studii, debutul astmului a fost asociat cu rinita alergică, iar în studiul din Statele Unite ale Americii, după stratificare, rinita a crescut riscul dezvoltării astmului de aproximativ trei ori atât în rândul pacienţilor atopici, cât şi în rândul celor nonatopici. Autorii au concluzionat că rinita este un factor semnificativ de risc pentru debutul astmului la adulţi, atât în rândul subiecţilor atopici, cât şi al celor nonatopici. Nu este clar dacă rinita alergică reprezintă o manifestare clinică precoce a bolii alergice la subiecţii atopici care vor dezvolta ulterior astm sau dacă boala nazală în sine este cauzatoare de astm. Prezenţa hiperreactivităţii bronşice şi a altor manifestări atopice concomitent în copilărie creşte riscul de a dezvolta ulterior astm şi ar trebui recunoscută drept un marker cu semnificaţie prognostică, în timp ce absenţa acestor manifestări prezice un risc foarte scăzut de a dezvolta ulterior astm (Bousquet et al., 2008; Wright et al., 1994). Rinita alergică precedă de obicei dezvoltarea astmului, forma de rinită persistentă, moderat-severă şi netratată fiind un factor de risc semnificativ pentru astm. Coexistenţa celor două afecţiuni este asociată cu un control slab al astmului (Compalati et al., 2010; Bousquet et al., 2008).
Alergenii respiratorii au fost raportaţi ca factori de risc atât pentru rinita alergică, dar şi pentru astmul alergic. Cei mai frecvenţi alergeni asociaţi cu astmul sunt alergenii proveniţi de la acarienii din praful de casă, polenuri şi animale de companie. Mai mult, cei mai frecvenţi alergeni asociaţi cu forme severe de astm sunt cei proveniţi de la gândaci, animale de companie, acarienii din praful de casă şi mucegaiuri (Alternaria şi Cladosporium) (Lombardi et al., 2017). Într-un studiu transversal internaţional realizat pe eşantioane de adulţi tineri care au completat un chestionar detaliat şi au fost supuşi testelor funcţionale pulmonare, testelor de provocare bronşică, măsurătorilor IgE şi testelor cutanate, s-a evaluat asocierea dintre astm şi rinita alergică în funcţie de sensibilizarea la anumiţi alergeni. Rezultatele au arătat că, în toate ţările, astmul şi hiperreactivitatea bronşică au fost mai frecvente la subiecţii cu rinită alergică decât la cei fără. În rândul subiecţilor cu astm, proporţia celor care au raportat rinită a fost de 74,2% la cei sensibilizaţi la acarienii din praful de casă, 78,6% la cei sensibilizaţi la scuame de pisică, 80,9% la cei sensibilizaţi la mucegaiuri şi 81% la cei sensibilizaţi la polen. În schimb, în rândul subiecţilor cu rinită, proporţia subiecţilor cu astm a fost de 22,3% la cei cu rinită sensibilizaţi la acarieni, 26,3% la subiecţii cu rinită sensibilizaţi la pisică, 21,9% la subiecţii cu rinită sensibilizaţi la mucegai şi 15,8% la cei cu rinită sensibilizaţi la polen. Riscul de astm a crescut de la 2% la subiecţii fără simptome de rinită la 6,7% la subiecţii cu simptome de rinită doar când sunt expuşi la polen, 11,9% la subiecţii cu simptome de rinită doar când sunt expuşi la scuame de animale sau la acarienii din praful de casă şi 18,8% la subiecţii cu oricare dintre simptome când sunt expuşi la polen şi la animale. Studiul a concluzionat că rezultatele obţinute sunt în concordanţă cu ipoteza că rinita alergică ar putea creşte riscul de astm (Leynaert et al., 2004).
Căile respiratorii superioare şi inferioare
În prezent, există date epidemiologice şi studii clinice care sugerează o relaţie structurală şi funcţională strânsă între căile respiratorii superioare şi cele inferioare. Conceptul de „o singură boală a căilor respiratorii”, conform căruia căile respiratorii superioare şi cele inferioare constituie o singură entitate morfofuncţională, iar simptomatologia reflectă acelaşi proces subiacent, cu anumite diferenţe epidemiologice, fiziopatologice şi clinice, reprezintă piatra de temelie a ghidului ARIA şi are implicaţii semnificative în ceea ce priveşte managementul diagnostic şi terapeutic al alergiilor respiratorii (Compalati et al., 2010; Acevedo-Prado et al., 2022).
Există similitudini între mucoasa nazală şi mucoasa bronşică, iar unul dintre conceptele de importanţă majoră referitoare la interacţiunile dintre nas şi plămâni este reprezentat de complementaritatea funcţională. Mucoasa căilor respiratorii superioare şi inferioare, până la nivelul bronhiolelor, este acoperită de un epiteliu ciliat columnar pseudostratificat, dispus pe o membrană bazală continuă. Există tot mai multe dovezi care sugerează o implicare majoră a celulelor epiteliale atât în patogeneza rinitei alergice, cât şi în cea a astmului. În submucoasă se găsesc vase de sânge şi glande mucoase, alături de celule structurale (fibroblaste), celule inflamatorii (monocite, limfocite şi mastocite) şi nervi. Distincţia majoră dintre cele două compartimente constă în faptul că la nivel nazal există o reţea mare de capilare subepiteliale, sisteme arteriale şi sinusuri venoase cavernoase, situate într-o structură rigidă, în timp ce, la nivel pulmonar, căile respiratorii inferioare sunt înconjurate de muşchi neted de la trahee până la bronhiole şi sunt conţinute într-un parenchim elastic. Au fost stabilite mecanisme care susţin interacţiunile fiziopatologice dintre căile respiratorii superioare şi cele inferioare, precum procese inflamatorii comune şi reflexe nervoase. Atât în rinita alergică, cât şi în astmul alergic, expunerea la alergeni declanşează o reacţie inflamatorie IgE-mediată la nivelul mucoasei nazale şi bronşice, menţinută de un infiltrat inflamator similar, format din eozinofile, mastocite, limfocite T, monocite şi mediatori proinflamatori similari, precum histamina, cisteinil-leucotriene, citokine Th2 şi chemokine. Distincţia anatomică dintre cele două compartimente explică diferenţa de răspuns la contactul cu alergeni, generând o reacţie inflamatorie care la nivelul căilor respiratorii superioare determină rinoree apoasă şi obstrucţie nazală, iar la nivelul căilor respiratorii inferioare determină secreţii şi bronhoconstricţie (Bousquet et al., 2008; Compalati et al., 2010). Autopsiile efectuate asupra persoanelor decedate din cauza astmului au demonstrat prezenţa inflamaţiei eozinofilice în întregul tract respirator, de la mucoasa nazală până la ţesutul pulmonar. De asemenea, reflexul nazal-bronşic este bine documentat pe modelele animale, generând o amplificare a rezistenţei în căile respiratorii inferioare în urma provocării nazale cu aer rece sau cu alergeni. Pot fi detectate modificări subclinice la nivelul căilor respiratorii inferioare şi ale mediatorilor inflamatori chiar şi la pacienţii cu rinită care nu suferă de astm (Acevedo-Prado et al., 2022).
Bariera fizică epitelială
Bariera epitelială este subdivizată în bariera fizică, chimică, imună şi microbiologică, colaborând pentru menţinerea stabilităţii mucoasei. Bariera fizică a epiteliului separă mediul intern şi cel extern, fiind importantă pentru protecţia împotriva alergenilor, agenţilor patogeni şi altor iritanţi. Această barieră include joncţiuni strânse, joncţiuni de adeziune, joncţiuni gap, desmozomi şi alte componente. Joncţiunile strânse au o importanţă semnificativă în menţinerea integrităţii epiteliului. Complexul multiproteic ocupă o poziţie apicală pe celulele epiteliale şi este format din proteine transmembranare, proteine asociate membranei şi proteine solubile citoplasmatice, reprezentând astfel un determinant al permeabilităţii intercelulare, limitând transportul macromoleculelor. De asemenea, aceste joncţiuni sunt responsabile de supravegherea imună şi pot preveni invazia particulelor străine în straturile subepiteliale. Aproximativ 40 de proteine diferite au fost identificate ca fiind componente ale joncţiunilor strânse, iar acestea includ principalele proteine transmembrane care fac parte din familia claudinelor (26 de membri la oameni) şi cele trei proteine ale domeniului MARVEL joncţional (MAL şi proteine asociate pentru traficul vezicular şi legătura membranară): ocludina, tricelulina şi MARVELD3, care reglează recrutarea proteinelor complexe de semnalizare la joncţiunile strânse. (Kast et al., 2012). Alte joncţiuni strânse transmembranare includ moleculele de adeziune joncţională (JAM), receptorul pentru coxsackievirus şi adenovirus, precum şi anguline (cunoscute şi sub denumirea de receptori stimulaţi de lipoliză pentru lipoproteine). Un rol esenţial pentru funcţia de barieră a epiteliului îl joacă moleculele citoplasmatice zonula occludens (ZO)-1, ZO-2 şi ZO-3, care se leagă direct de ocludină şi de claudină la un capăt şi la fibrele de actină la celălalt capăt (Noureddine et al., 2022). Joncţiunile de adeziune sunt complexe de adeziune cadherină-catenină situate sub joncţiunile strânse şi au un rol important în homeostazia ţesuturilor, stabilizare şi semnalizare transcripţională şi intracelulară. Moleculele de adeziune cadherină sunt componente de bază ale joncţiunilor de adeziune. Terminaţia citozolică a cadherinei clasice se leagă de catenine, permiţând formarea de legături cu reţelele citoscheletale, precum şi cu mecanismul de exocitoză şi endocitoză. Comunicarea dintre grupurile cadherină-catenină şi reglatorii actinici controlează asamblarea joncţiunilor de adeziune de la primele contacte celulă-celulă (Noureddine et al., 2022). Proteinele de joncţiune gap, conexinele, exprimate în diferite tipuri de celule în ţesutul pulmonar, coordonează frecvenţa bătăilor ciliare, permit fluxul direct al moleculelor de semnalizare şi metaboliţilor între celule şi reglează inflamaţia (Noureddine et al., 2022). Desmozomii sunt complexe proteice adezive specializate responsabile de menţinerea integrităţii mecanice a ţesuturilor (Dubash et al., 2011). Aceştia pot acţiona, de asemenea, ca centre de semnalizare, reglând disponibilitatea moleculelor de semnalizare şi participând la procese fundamentale, precum proliferarea, diferenţierea şi morfogeneza celulelor. Compoziţia şi dimensiunea desmozomilor variază în funcţie de expresia specifică a ţesutului şi de starea de diferenţiere. Proteinele constitutive ale acestora sunt puternic reglate prin modificări posttranslaţionale care controlează funcţia lor chiar în desmozom şi reglează multe alte funcţii independent de desmozom (Müller et al., 2021). Toate aceste componente ale epiteliului căilor respiratorii, pe lângă funcţiile lor specifice, interacţionează îndeaproape între ele pentru a forma şi a menţine polaritatea celulelor epiteliale din partea apicală şi bazolaterală (Noureddine et al., 2022).
Alergeni cu activitate proteazică
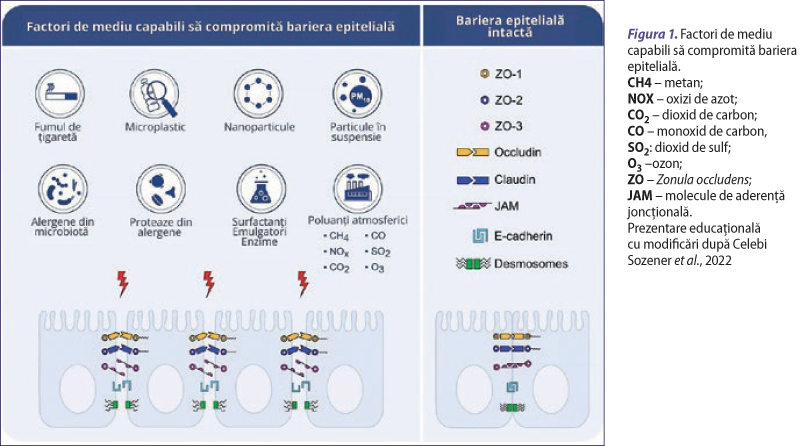
Studii recente au raportat un număr considerabil de factori de mediu capabili să compromită integritatea epiteliului, perturbând astfel funcţia sa de barieră. Printre aceşti factori de mediu se numără alergenii care conţin proteaze, bacteriile, virusurile, particulele în suspensie (PM), particulele de emisii diesel (DEP), nanoparticulele, microplasticul, surfactanţi, emulgatori, enzime şi fumul de ţigaretă (figura 1) (Zhang et al., 2023; Celebi Sozener et al., 2022).
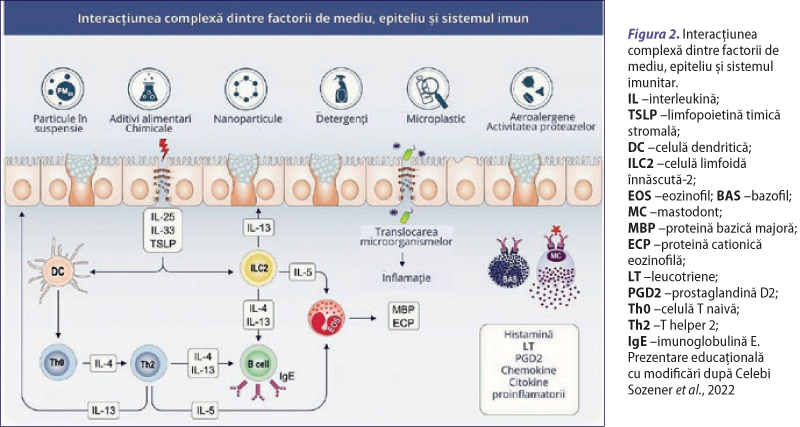
Multe studii au demonstrat că activitatea proteazică a unor proteine provenite din diferite surse de alergeni contribuie la alergenicitatea acestora. Aceste proteine sunt stabile, abundente în sursele lor alergenice (până la câteva sute de µg/g de extract pentru cele foarte bine exprimate), capabile să inducă inflamaţie alergică la nivelul căilor respiratorii şi joacă un rol-cheie în exacerbarea răspunsurilor alergice din cauza activităţii lor proteazice (Soh et al., 2023). Aceste proteaze au capacitatea de a modula răspunsurile imune prin: 1) perturbarea echilibrului protează-antiprotează la nivelul suprafeţelor epiteliale, 2) perturbarea barierei epiteliale respiratorii, 3) activarea celulelor epiteliale de la nivelul căilor respiratorii, 4) modularea activităţii celulelor imune şi 5) prin scindarea receptorilor de pe suprafaţa celulară (figura 2).
Prin capacitatea lor de a activa căi inflamatorii independente de IgE, anumite proteaze alergenice sunt considerate iniţiatori de sensibilizare pentru ele însele şi pentru alergeni fără activitate proteazică. Proteazele din alergeni degradează proteinele joncţionale ale epiteliului căilor respiratorii pentru a facilita transportul alergenului prin bariera epitelială şi preluarea ulterioară de către celulele prezentatoare de antigen. Leziunile epiteliale determinate de aceste proteaze, împreună cu detectarea lor de către receptori activaţi de proteaze (PAR) declanşează răspunsuri inflamatorii puternice, care duc la eliberarea de citokine pro-Th2, precum IL-6, IL-25, IL-1β, TSLP, şi modele moleculare asociate pericolelor (DAMP), precum IL-33, ATP şi acid uric. Până în prezent, puţini alergeni de tip serin-protează au fost identificaţi că vizează direct PAR, PAR-2 fiind cel mai important exemplu. Alergenii şi extractele brute cu proteaze PAR-2 reglatoare documentate sunt cei proveniţi de la acarienii din praful de casă, mucegaiuri şi gândaci. Expresia PAR-2 este crescută în căile respiratorii ale pacienţilor cu astm şi în monocitele periferice ale pacienţilor cu astm sever (Soh et al., 2023). Recent, s-a demonstrat că proteazele din alergeni pot tăia domeniul senzor al IL-33 pentru a produce o formă superactivă a acestei alarmine. Expunerea la proteaze active duce la niveluri mai ridicate de IL‑33 în plămâni, iar şoarecii cu deficit de IL‑33 au prezentat niveluri reduse de IgE/IgG1 fără eozinofilie, demonstrând rolul IL‑33 în sensibilizarea indusă de proteaze. De asemenea, studiile au arătat că, dintre şoarecii sensibilizaţi prin mucoasa nazală cu cistein-protează activă şi inactivă, au prezentat hipersensibilitate pulmonară de tip Th2 şoarecii sensibilizaţi cu cistein-protează activă. Acest experiment a demonstrat, de asemenea, că activitatea cistein-proteazei acţionează ca un adjuvant pentru alte antigene alăturate (Soh et al., 2023).
Au fost identificate şi caracterizate proteaze provenite de la alergeni din diverse surse, precum acarienii din praful de casă, gândacii de bucătărie, polenurile şi mucegaiurile. Acarienii din praful de casă şi câteva tipuri de polen conţin proteaze precum cisteină şi serină, iar mucegaiurile, precum Aspergillus şi Penicillium, manifestă activitate de serin-protează care pot perturba bariera epitelială (Celebi Sozener et al., 2022).
Acarienii din praful de casă
Cele mai importante specii de acarieni sunt Dermatophagoides pteronyssinus, Dermatophagoides farinae şi Blomia tropicalis. În studii recente s-a estimat că între 65 şi 130 de milioane de persoane la nivel mondial sunt sensibilizate la acarienii din praful de casă, iar în ţările industrializate acest număr reprezintă 15-20% din populaţie (Calderón et al., 2015; Wang et al., 2013; Sala-Cunill et al., 2013; Colloff et al., 2010). În Europa Centrală, 50% dintre pacienţii alergici sunt sensibilizaţi la acarienii din praful de casă (Jacquet, 2015). Aproximativ 50% dintre pacienţii astmatici sunt sensibilizaţi la acarienii din praful de casă. Se consideră că prezenţa unui număr mare de alergeni cu activitate proteazică din acarienii din praful de casă contribuie la potenţialul lor alergenic ridicat. Aceste proteaze au activitate proteolitică puternică, ce poate contribui la procesul de sensibilizare alergică şi la progresia bolii. Proteazele acarienilor din praful de casă clivează diferite substraturi care sunt implicate în diverse mecanisme imune, începând cu funcţia de barieră epitelială, continuând cu răspunsurile inflamatorii înnăscute, care implică polarizarea celulelor T şi au un impact direct asupra producţiei de IgE de către celulele B (Reithofer şi Jahn-Schmid, 2017). Alergenii din grupul 1 (Der p 1, Der f 1, Der m 1, Der s 1, Eur m 1, Blo t 1, Pso o 1, Sar s 1) fac parte din familia cistein-proteazelor şi sunt prezenţi în cantităţi mari în paletele fecale ale acarienilor din praful de casă, sugerând un rol biologic în tractul digestiv al acarienilor. Pe lângă alergenii din grupul 1, acarienii din praful de casă conţin şi alţi alergeni cu potenţial proteolitic puternic, în special serin-proteazele din grupul 3 (Der p 3, Der f 3, Der s 3, Eur m 3, Blo t 3, Sar s 3, Gly d 3, Lep d 3), grupul 6 (Der p 6, Der f 6, Blo t 6) şi grupul 9 (Der p 9, Der f 9, Blo t 9). Primul alergen de la acarienii din praful de casă descris şi cel mai intens studiat până în prezent este Der p 1, o glicoproteină de 25 kDa (Reithofer şi Jahn-Schmid, 2017). Puternica activitate proteazică a componentei Der p 1 a stârnit un interes deosebit în cercetarea alergiilor. Prin compararea producţiei de anticorpi la şoareci imunizaţi cu Der p 1 sau Der p 1 cu situsul său proteolitic inhibat ireversibil, s-a arătat că activitatea enzimatică a Der p 1 are impact asupra alergenicităţii sale (Kikuchi et al., 2006). S-a demonstrat că, prin activitatea sa de protează, Der p 1 creşte permeabilitatea căilor respiratorii prin clivarea proteinelor care formează joncţiunile strânse. În mod normal, aceste joncţiuni împiedică intrarea necontrolată a alergenilor, dar perturbarea barierei epiteliale favorizează afluxul crescut de alergeni, aşa-numita „circulaţie facilitată a alergenilor”. Recent s-a stabilit că expunerea epiteliului nazal la Der p 1 duce atât la clivarea proteinelor de joncţiune strânsă deja prezente, cât şi la scăderea expresiei acestor proteine (Reithofer şi Jahn-Schmid, 2017; Herbert et al., 1995). Cu toate acestea, s-a dezbătut recent faptul că alergenicitatea grupului 1 de alergeni se datorează mai degrabă expunerii la particule care conţin cantităţi mari de alergen în combinaţie cu molecule imunostimulatoare decât la activitatea proteolitică intrinsecă a acestuia (Matricardi et al., 2016). În tractul respirator uman, lichidul de suprafaţă al căilor respiratorii conţine cisteină sau glutation, care sunt cunoscute să reactiveze alergenii de grup 1 ai acarienilor din praful de casă in vitro şi, probabil, orice alt alergen cistein-proteazic (Soh et al., 2023).
Iniţial s-a raportat că principala componentă alergenică a Dermatophagoides pteronyssinus, Der p 1, poate activa PAR-2, dar studiile ulterioare au arătat că Der p 1 desface PAR-2 la nivelul unui situs nonactivator. În contrast, enzima Der p 3 de tip tripsină şi Der p 9 de tip colagenază activează PAR-2 în celulele epiteliale ale căilor respiratorii şi induc eliberarea de citokine şi chemokine, inclusiv GM-CSF şi eotaxină. Similar, enzima alergenică Der f 3 (80% omolog cu Der p 3), din Dermatophagoides farinae, induce eliberarea de IL-6, IL-8 şi GM-CSF din celulele epiteliale ale căilor respiratorii prin activitatea sa proteazică şi activarea PAR-2 (Soh et al., 2023; Li et al., 2019). Printre alergenii proveniţi de la acarienii din praful de casă, s-a arătat că Der f 3 activează şi PAR-1 în plus faţă de PAR-2, în timp ce Der p 3 poate activa PAR-4 şi duce la activarea canalelor de calciu dependente de stocare prin intermediul PAR-4 în mastocite. Componenta Der p 1 poate activa trombina, care apoi are efecte mediate de PAR-1 asupra celulelor epiteliale ale căilor respiratorii (Li et al., 2019; Lin et al., 2018; Zhang et al., 2016)
Polenurile
Polenurile sunt factori declanşatori importanţi ai rinitei alergice şi ai astmului. Cantităţi semnificative de particule de polen se pot acumula în mucoasa epiteliului căilor respiratorii, în funcţie de tipul de polen, de starea fiziologică a individului, de intensitatea expunerii la polen, de localizarea geografică şi de perioada anului. După inhalare, polenul se hidratează pe suprafaţa epiteliului respirator, ceea ce duce la eliberarea rapidă a conţinutului său, inclusiv alergeni, proteaze, NADPH-oxidaze (forma redusă a nicotinamid adenin dinucleotid fosfatului), lipoproteine, polizaharide, lipide şi compuşi fenolici. Proteazele eliberate în momentul hidratării particulelor de polen au un rol major în răspunsurile imune şi inflamatorii tipice care apar la pacienţii cu tulburări alergice (Vinhas et al., 2011; Hassim et al., 1998). Leziunea epitelială a fost recunoscută ca fiind un element-cheie în declanşarea inflamaţiei şi remodelarea căilor respiratorii. Integritatea barierei epiteliale depinde de continuitatea stratului superficial de celule columnare şi de eficienţa joncţiunilor aderente şi strânse. Enzimele proteolitice provenite din polen afectează funcţia de barieră a epiteliului polarizat prin creşteri semnificative ale permeabilităţii transepiteliale şi prin degradarea complexelor proteice intercelulare. Unele studii au relevat o perturbare dramatică a E-caderinei, claudinei-1, ocludinei şi a complexului citosolic ZO-1, sugerând că această creştere a permeabilităţii poate fi datorată activităţii proteolitice a acestor proteine. Dintre proteinele studiate, E-caderina, care este cunoscută de mult timp pentru contribuţia sa la asamblarea altor joncţiuni specializate intercelulare, a fost cea mai degradată de particulele de polen. Clivarea joncţiunilor proteice intercelulare şi creşterea permeabilităţii transepiteliale facilitează expunerea alergenilor la substraturile epiteliale, promovează contactul alergenilor cu celulele dendritice prezentatoare de antigen, facilitând în cele din urmă activarea sistemului imunitar şi contribuind la sensibilizarea faţă de o gamă largă de alergeni. Acest proces poate iniţia sau exacerba răspunsul imun alergic, producţia de IgE alergen-specifice şi poate perpetua inflamaţia de tip Th2. Pierderea integrităţii barierei epiteliale poate apărea şi prin activarea PAR-2, care sunt larg exprimaţi pe celulele epiteliale, celulele endoteliale, muşchii netezi ai căilor respiratorii şi fibroblaste. Alergenii care au activitate proteolitică pot activa PAR de pe suprafaţa celulelor, promovând eliberarea de chemokine, citokine şi factori de creştere, care duc la activarea celulelor epiteliale şi a altor celule ale sistemului imunitar. Cei patru mesageri secundari clasici produşi în urma activării PAR-2, respectiv Ca2+, adenozin monofosfat ciclic (cAMP), proteinele G şi protein-kinaza C (PKC), influenţează proprietăţile complexelor proteice care formează joncţiunile strânse. Activarea PAR-2 pare să promoveze deschiderea canalelor de calciu şi influxul de calciu în citoplasmă. Activarea proteolitică a PAR-2 ar putea avea un impact indirect asupra degradării epiteliului prin activarea cascadelor interne de semnalizare inflamatorie (Gaspar et al., 2020). Totodată, serin-proteazele din extractele de polen pot induce eliberarea unor DAMP-uri, precum acidul uric şi ATP de către celulele epiteliale bronşice (Soh et al., 2023).
Mucegaiurile
Speciile de Aspergillus sunt cele mai comune ciuperci găsite în căile respiratorii, iar proteazele lor contribuie la boli precum aspergiloza bronhopulmonară alergică şi astmul atopic. Dintre pacienţii cu astm care necesită trimitere la medic, 20-25% prezintă reacţie pozitivă la Aspergillus şi la alţi fungi la testul cutanat. Alergenii cu activitate proteazică din Aspergillus pot perturba funcţia de barieră a epiteliului şi pot induce o reacţie inflamatorie. În plus, proteazele alergenice generează specii reactive de oxigen care au efecte toxice asupra ţesuturilor epiteliale şi afectează moleculele de semnalizare implicate în răspunsurile imune (Kim şi Lee, 2018). Un studiu recent a arătat că serin-proteaza Asp f 13 din Aspergillus fumigatus a deteriorat E-caderina şi joncţiunile strânse ale epiteliului căilor respiratorii. În celulele cubice bronhiolare, un subset distinct de celule epiteliale, această deteriorare de la nivelul joncţiunilor a declanşat un influx de calciu detectat de mecanoreceptorul TRPV4, conducând la inflamaţie alergică (Wiesner et al., 2020). Expunerea căilor respiratorii ale şoarecilor naivi la proteaza din Aspergillus a promovat producţia de IL-33. O astfel de secreţie de IL-33 dependentă de protează este crucială pentru recrutarea şi activarea celulelor ILC2 (Hiraishi et al., 2018; Halim et al., 2014). Pe lângă acestea, activitatea de serin-protează a Asp f 13 a provocat o hiperreactivitate bronşică prin infiltrare la nivelul submucoasei bronşice la şoareci. Fără o sensibilizare alergică prealabilă, componenta Asp f 13 este capabilă să moduleze în celulele musculare netede de la nivel bronşic schimbări majore în morfologia celulară, mobilizarea Ca2+ şi degradarea matricei extracelulare (Balenga et al., 2015; Soh et al., 2023). Alternaria alternata este un alergen complex cu multe proteine potenţial sensibilizante care pot influenţa direct biologia celulelor epiteliale ale căilor respiratorii. Eroziunea barierei epiteliale apare şi în culturile primare de celule sinonazale umane expuse la activitatea de serin-protează a extractelor de Alternaria (Boitano et al., 2011). De asemenea, acestea pot induce eliberarea unor DAMP-uri, precum acidul uric şi ATP, de către celulele epiteliale bronşice umane. Serin-proteaza alcalină din Alternaria activează direct PAR-2 şi induce inflamaţia alergică a căilor respiratorii la şoareci (Soh et al., 2023; Yee et al., 2018). În plus, s-a demonstrat că diverse extracte alergenice fungice, inclusiv cele de Alternaria şi Aspergillus, activează celulele epiteliale ale căilor respiratorii şi induc citokine prin intermediul PAR-2, dar proteazele exacte care mediază aceste efecte nu au fost identificate (Soh et al., 2023; Matsuwaki et al., 2009).
Dezechilibrul proteinelor joncţionale de la nivelul epiteliului căilor respiratorii a fost observat şi în celulele epiteliale ale căilor respiratorii tratate cu serin-proteaza alcalină alergenică Pen c 13, alergen major din Penicillium citrinum (Soh et al., 2023). Totodată, această serin-protează fungică poate cliva PAR-1 şi PAR-2 la situsurile lor de activare şi desensibilizează celulele epiteliale ale căilor respiratorii la creşterea calciului intracelular indusă de agoniştii PAR-1 şi PAR-2 (Chiu et al., 2007). În plus, prin incubarea celulelor epiteliale umane ale căilor respiratorii cu Pen c 13, induce producţia de citokine, care este inhibată de anticorpii care previn clivarea fie a PAR-1, fie a PAR-2. Activitatea proteolitică a serin-proteazei alcaline Pen ch 13 din Penicillium chrysogenum reglează în jos expresia CD44 (molecule de adeziune implicate în procesele de reglare a inflamaţiei pulmonare şi de reparare a leziunilor epiteliale apărute în astm) în celulele epiteliale bronşice umane. Cu toate acestea, nu se ştie dacă această schimbare în expresia unui receptor implicat în repararea epitelială este rezultatul clivajului proteolitic efectuat de Pen ch 13 (Soh et al., 2023; Tai et al., 2010).
Gândacii de bucătărie
Studii recente au demonstrat activitatea proteolitică a unor alergeni proveniţi de la gândaci. S-a observat perturbarea proteinelor joncţionale de la nivelul epiteliului căilor respiratorii tratate cu serin-proteaza alergenică Per a 10 din Periplaneta americana (gândacul american) (Kale et al., 2017). Extractele de alergeni provenite de la gândaci activează celulele epiteliale ale căilor respiratorii într-un mod dependent de PAR-2 şi mediază sensibilizarea şoarecilor dependentă de PAR-2. Se ştiu mai puţine informaţii despre alergenii de gândac care pot activa PAR-2. Componenta Per a 10 induce efecte mediate de PAR-2 în celule purificate şi poate provoca sensibilizare alergică la şoareci. Similar, folosind o probă bazată pe activitatea specifică a tripsinei, s-a arătat că trei serin-proteaze din Blatella germanica (gândacul german) sunt foarte omoloage cu Per a 10 şi activează PAR-2. În final, extractele de gândac german au mediat răspunsurile inflamatorii dependente de PAR-2 ale eozinofilelor umane (Soh et al., 2023; Polley et al., 2017). Studiile au arătat că alergenii cu activitate proteazică proveniţi de la gândacul german capabili să inducă astm au iniţiat o inflamaţie PAR-2 dependentă de proteaze independent de sensibilizare (Page et al., 2010).
Concluzii
Prevalenţa bolilor alergice ale căilor respiratorii este în creştere în ultimele decenii, dar mecanismele care duc la răspunsuri imune de tip Th2 nu sunt pe deplin înţelese. Celulele epiteliale ale căilor respiratorii acţionează ca o primă linie de apărare împotriva patogenilor şi alergenilor respiratori. Celulele epiteliale ale mucoasei căilor respiratorii formează o barieră strânsă, practic impermeabilă pentru macromolecule, şi reglează transportul intercelular al materialului inhalat prin formarea de joncţiuni strânse la nivelul suprafeţelor apicale. Pentru a activa cascada imună, alergenii trebuie să perturbe bariera epitelială strânsă şi să aibă acces la componentele imune ale gazdei. Studiile prezentate evidenţiază rolul crucial al activităţii de protează a unor alergeni în inducerea şi exacerbarea reacţiilor alergice, în special în ceea ce priveşte afecţiunile căilor respiratorii, cum ar fi astmul şi rinita alergică. Proteazele provenite de la diverse surse de alergeni, cum ar fi acarienii din praful de casă, polenurile, mucegaiurile şi gândacii de bucătărie, au capacitatea de a influenţa în mod semnificativ răspunsurile imune şi inflamatorii. Aceste proteaze acţionează prin mai multe mecanisme, inclusiv perturbarea echilibrului protează-antiprotează la nivelul suprafeţelor epiteliale, deteriorarea barierei epiteliale respiratorii, activarea celulelor epiteliale şi modularea activităţii celulelor imune. Ele pot induce, de asemenea, eliberarea de citokine proinflamatorii precum IL-6, IL-25, IL-1β, TSLP şi DAMP-uri (modele moleculare asociate pericolelor), cum ar fi IL-33, ATP şi acid uric. Un aspect interesant este legat de activarea receptorilor de pe suprafaţa celulară, cum ar fi receptorii activaţi de proteaze (PAR). Alergenii cu activitate proteazică, precum cei proveniţi de la acarienii din praful de casă, pot tăia domeniul senzor al IL-33 pentru a produce o formă superactivă a acestei alarmine, contribuind astfel la sensibilizarea indusă de proteaze. În ceea ce priveşte alergenii specifici, precum acarienii din praful de casă, se remarcă Der p 1, care, prin puternica sa activitate proteazică, poate influenţa permeabilitatea căilor respiratorii şi poate facilita circulaţia crescută a alergenilor. De asemenea, activitatea proteazică a alergenilor proveniţi de la polenuri şi mucegaiuri poate perturba funcţia de barieră a epiteliului şi poate induce reacţii inflamatorii. Înţelegerea mecanismelor prin care activitatea proteazică a alergenilor influenţează răspunsurile imune şi inflamatorii ale organismului este esenţială pentru dezvoltarea strategiilor de prevenire şi tratament al reacţiilor alergice, în special în contextul afecţiunilor respiratorii.
Autor corespondent:
Carmen Panaitescu
E-mail: cbunu@umft.ro
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Acevedo-Prado A, Seoane-Pillado T, López-Silvarrey-Varela A, Salgado FJ, Cruz MJ, Faraldo-Garcia A, Nieto-Fontarigo JJ, Pértega-Díaz S, Sanchez-Lastres J, San-José-González MA, Bamonde-Rodríguez L, Garnelo-Suárez L, Pérez-Castro T, Sampedro-Campos M, Gonzalez-Barcala FJ. Association of rhinitis with asthma prevalence and severity. Sci Rep. 2022 Apr 16;12(1):6389. doi: 10.1038/s41598-022-10448-w.
- Boitano S, Flynn AN, Sherwood CL, et al. Alternaria alternata serine proteases induce lung inflammation and airway epithelial cell activation via PAR2. Am J Physiol Lung Cell Mol Physiol. 2011;300(4):L605-L614. doi:10.1152/ajplung.00359.2010.
- Bousquet J, Khaltaev N, Cruz AA, et al.; World Health Organization; GA(2)LEN; AllerGen. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008 Apr;63 Suppl 86:8-160. doi: 10.1111/j.1398-9995.2007.01620.x.
- Burgess JA, Walters EH, Byrnes GB, Matheson MC, Jenkins MA, Wharton CL, Johns DP, Abramson MJ, Hopper JL, Dharmage SC. Childhood allergic rhinitis predicts asthma incidence and persistence to middle age: a longitudinal study. J Allergy Clin Immunol. 2007 Oct;120(4):863-9.
- Calderón MA, Kleine-Tebbe J, Linneberg A, De Blay F, Hernandez Fernandez de Rojas D, Virchow JC, Demoly P. House Dust Mite Respiratory Allergy: An Overview of Current Therapeutic Strategies. J Allergy Clin Immunol Pract. 2015 Nov-Dec;3(6):843-55.
- Celebi Sozener Z, Ozdel Ozturk B, Cerci P, Turk M, Gorgulu Akin B, Akdis M, Altiner S, Ozbey U, Ogulur I, Mitamura Y, Yilmaz I, Nadeau K, Ozdemir C, Mungan D, Akdis CA. Epithelial barrier hypothesis: Effect of the external exposome on the microbiome and epithelial barriers in allergic disease. Allergy. 2022 May;77(5):1418-1449. doi: 10.1111/all.15240.
- Chiu LL, Perng DW, Yu CH, Su SN, Chow LP. Mold allergen, pen C 13, induces IL-8 expression in human airway epithelial cells by activating protease-activated receptor 1 and 2. J Immunol. 2007 Apr 15;178(8):5237-44.
- Colloff, M.J. Dust Mites; Springer: Dordrecht, The Netherlands, 2010.
- Compalati E, Ridolo E, Passalacqua G, Braido F, Villa E, Canonica GW. The link between allergic rhinitis and asthma: the united airways disease. Expert Rev Clin Immunol. 2010 May;6(3):413-23. doi: 10.1586/eci.10.15.
- Dubash AD, Green KJ. Desmosomes. Curr Biol. 2011 Jul 26;21(14):R529-31. doi: 10.1016/j.cub.2011.04.035.
- Gaspar R, de Matos MR, Cortes L, Nunes-Correia I, Todo-Bom A, Pires E, Veríssimo P. Pollen Proteases Play Multiple Roles in Allergic Disorders. Int J Mol Sci. 2020 May 19;21(10):3578. doi: 10.3390/ijms21103578. 2.
- Halim TY, Steer CA, Matha L, et al. Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation. Immunity. 2014;40(3):425-435. doi:10.1016/j.immuni.2014.01.011
- Hassim Z, Maronese SE, Kumar RK. Injury to murine airway epithelial cells by pollen enzymes. Thorax. 1998 May;53(5):368-71.
- Herbert CA, King CM, Ring PC, Holgate ST, Stewart GA, Thompson PJ, Robinson C. Augmentation of permeability in the bronchial epithelium by the house dust mite allergen Der p1. Am J Respir Cell Mol Biol. 1995 Apr;12(4):369-78.
- Hiraishi Y, Yamaguchi S, Yoshizaki T, et al. IL-33, IL-25 and TSLP contribute to development of fungal-associated protease-induced innate-type airway inflammation. Sci Rep. 2018;8(1):18052. doi:10.1038/s41598-018-36440-x.
- Jacquet A. Interactions of airway epithelium with protease allergens in the allergic response. Clin Exp Allergy. 2011 Mar;41(3):305-11.
- Kale SL, Agrawal K, Gaur SN, Arora N. Cockroach protease allergen induces allergic airway inflammation via epithelial cell activation. Sci Rep. 2017;7:42341. doi:10.1038/srep4234.1
- Kast JI, Wanke K, Soyka MB. The broad spectrum of interepithelial junctions in skin and lung. J Allergy Clin Immunol. 2012 Aug;130(2):544-7.e4. doi: 10.1016/j.jaci.2012.04.044.
- Kikuchi Y, Takai T, Kuhara T, Ota M, Kato T, Hatanaka H, Ichikawa S, Tokura T, Akiba H, Mitsuishi K, Ikeda S, Okumura K, Ogawa H. Crucial commitment of proteolytic activity of a purified recombinant major house dust mite allergen Der p1 to sensitization toward IgE and IgG responses. J Immunol. 2006 Aug 1;177(3):1609-17.
- Kim YH, Lee SH. TGF-β/SMAD4 mediated UCP2 downregulation contributes to Aspergillus protease-induced inflammation in primary bronchial epithelial cells. Redox Biol. 2018 Sep;18:104-113. doi: 10.1016/j.redox.2018.06.011.
- Leynaert B, Neukirch C, Kony S, Guénégou A, Bousquet J, Aubier M, Neukirch F. Association between asthma and rhinitis according to atopic sensitization in a population-based study. J Allergy Clin Immunol. 2004 Jan;113(1):86-93. doi: 10.1016/j.jaci.2003.10.010. 2.
- Li B, Zou Z, Meng F, et al. Dust mite-derived Der f 3 activates a pro-inflammatory program in airway epithelial cells via PAR-1 and PAR-2. Mol Immunol. 2019;109:1-11.
- Lin YP, Nelson C, Kramer H, Parekh AB. The allergen Der p3 from house dust mite stimulates store-operated Ca(2+) channels and mast cell migration through PAR4 receptors. Mol Cell. 2018;70(2):228-241.e5. doi:10.1016/j.molcel.2018.03.025.
- Lombardi C, Savi E, Ridolo E, Passalacqua G, Canonica GW. Is allergic sensitization relevant in severe asthma? Which allergens may be culprit? World Allergy Organ J. 2017 Jan 6;10(1):2. doi: 10.1186/s40413-016-0138-8. 2.
- Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, Aalberse RC, Agache I, Asero R, Ballmer-Weber B, Barber D, Beyer K, Biedermann T, Bilò MB, Blank S, Bohle B, Bosshard PP, Breiteneder H, Brough HA, Caraballo L, Caubet JC, Crameri R, Davies JM, Douladiris N, Ebisawa M, EIgenmann PA, Fernandez-Rivas M, Ferreira F, Gadermaier G, Glatz M, Hamilton RG, Hawranek T, Hellings P, Hoffmann-Sommergruber K, Jakob T, Jappe U, Jutel M, Kamath SD, Knol EF, Korosec P, Kuehn A, Lack G, Lopata AL, Mäkelä M, Morisset M, Niederberger V, Nowak-Węgrzyn AH, Papadopoulos NG, Pastorello EA, Pauli G, Platts-Mills T, Posa D, Poulsen LK, Raulf M, Sastre J, Scala E, Schmid JM, Schmid-Grendelmeier P, van Hage M, van Ree R, Vieths S, Weber R, Wickman M, Muraro A, Ollert M. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016 May;27 Suppl 23:11–16.
- Matsuwaki Y, Wada K, White TA, et al. Recognition of fungal protease activities induces cellular activation and eosinophilderived neurotoxin release in human eosinophils. J Immunol. 2009;183(10):6708-6716. doi:10.4049/jimmunol.0901220.
- Müller L, Hatzfeld M, Keil R. Desmosomes as Signaling Hubs in the Regulation of Cell Behavior. Front Cell Dev Biol. 2021 Sep 23;9:745670. doi: 10.3389/fcell.2021.745670. 2.
- Noureddine N, Chalubinski M, Wawrzyniak P. The Role of Defective Epithelial Barriers in Allergic Lung Disease and Asthma Development. J Asthma Allergy. 2022 Apr 18;15:487-504. doi: 10.2147/JAA.S324080.
- Page K, Ledford JR, Zhou P, Dienger K, Wills-Karp M. Mucosal sensitization to German cockroach involves protease-activated receptor-2. Respir Res. 2010 May 24;11(1):62. doi: 10.1186/1465-9921-11-62.
- Pakkasela J, Ilmarinen P, Honkamäki J, Tuomisto LE, Andersén H, Piirilä P, Hisinger-Mölkänen H, Sovijärvi A, Backman H, Lundbäck B, Rönmark E, Kankaanranta H, Lehtimäki L. Age-specific incidence of allergic and non-allergic asthma. BMC Pulm Med. 2020 Jan 10;20(1):9.
- Polley DJ, Mihara K, Ramachandran R, et al. Cockroach allergen serine proteinases: isolation, sequencing and signalling via proteinase-activated receptor-2. Clin Exp Allergy. 2017;47(7):946-960. doi:10.1111/cea.12921.
- Reithofer M, Jahn-Schmid B. Allergens with Protease Activity from House Dust Mites. Int J Mol Sci. 2017 Jun 27;18(7):1368. doi: 10.3390/ijms18071368.
- Sala-Cunill A, Bartra J, Dalmau G, Tella R, Botey E, Raga E, Valero A; Comitè de Al-lergia Respiratòria de Catalunya, Spain. Prevalence of asthma and severity of allergic rhinitis comparing 2 perennial allergens: house dust mites and Parietaria judaica pollen. J Investig Allergol Clin Immunol. 2013;23(3):145-51.
- Soh WT, Zhang J, Hollenberg MD, Vliagoftis H, Rothenberg ME, Sokol CL, Robinson C, Jacquet A. Protease allergens as initiators-regulators of allergic inflammation. Allergy. 2023 May;78(5):1148-1168. doi: 10.1111/all.15678. 3.
- Tai HY, Tam MF, Chou H, Perng DW, Shen HD. Pen ch 13 major fungal allergen decreases CD44 expression in human bronchial epithelial cells. Int Arch Allergy Immunol. 2010;153(4):367-371. doi:10.1159/000316347.
- Vinhas R, Cortes L, Cardoso I, Mendes VM, Manadas B, Todo-Bom A, Pires E, Veríssimo P. Pollen proteases compromise the airway epithelial barrier through degradation of transmembrane adhesion proteins and lung bioactive peptides. Allergy. 2011 Aug;66(8):1088-98.
- Wang JY. The innate immune response in house dust mite-induced allergic inflammation. Allergy Asthma Immunol Res. 2013 Mar;5(2):68-74.
- Wiesner DL, Merkhofer RM, Ober C, et al. Club cell TRPV4 serves as a damage sensor driving lung allergic inflammation. Cell Host Microbe. 2020;27(4):614-628.e6. doi:10.1016/j.chom.2020.02.006.
- Wright AL, Holberg CJ, Martinez FD, Halonen M, Morgan W, Taussig LM. Epidemiology of physiciandiagnosed allergic rhinitis in childhood. Pediatrics. 1994;94(6 Pt 1):895-901.
- Yee MC, Nichols HL, Polley D, et al. Protease-activated receptor-2 signaling through beta-arrestin-2 mediates Alternaria alkaline serine protease-induced airway inflammation. Am J Physiol Lung Cell Mol Physiol. 2018;315(6):L1042-L1057. doi:10.1152/ajplung.00196.2018.
- Zhang J, Chen J, Allen-Philbey K, et al. Innate generation of thrombin and intracellular oxidants in airway epithelium by allergen Derp 1. J Allergy Clin Immunol. 2016;138(4):1224-1227. doi:10.1016/j.jaci.2016.05.006.
- Zhang R, Zhang L, Li P, Pang K, Liu H, Tian L. Epithelial Barrier in the Nasal Mucosa, Related Risk Factors and Diseases. Int Arch Allergy Immunol. 2023;184(5):481-501. doi: 10.1159/000528969.
Articole din ediţiile anterioare
Eficienţa şi siguranţa imunoterapiei specifice cu alergen în rinita alergică – experienţa unui centru de alergologie
Imunoterapia specifică cu alergen (ITS) reprezintă singura opţiune terapeutică care modifică evoluţia bolii alergice. ITS oferă o ameliorare clinic...
Dermatita atopică şi astmul – interrelaţii clinice
În ultimele decenii s-a înregistrat o creştere semnificativă a incidenţei bolilor alergice, afectând 20% din populaţia mondială, în special copiii ...
Recomandări de imunoterapie cu vaccinuri alergenice – ARIA 2019
Imunoterapia alergen specifică (AIT) este o opţiune terapeutică confirmată pentru tratamentul rinitei alergice şi/sau al astmului. S-au creat multe...
Efecte adverse neuropsihice induse de montelukast
Montelukast este un medicament din clasa antagoniştilor receptorilor de leucotriene şi este utilizat în tratamentul astmului bronşic. Deşi consider...