Allergen immunotherapy (AIT) is a specific treatment consisting of repeated administration of allergens with the aim of inducing immunological tolerance. It comprises two subtypes: subcutaneous immunotherapy (SCIT) and sublingual immunotherapy (SLIT). According to multiple studies, AIT improves the clinical symptoms, reduces airway hyperresponsiveness, improves asthma control and reduces the need for inhaled corticosteroids (ICS). In addition, this therapy is able to suppress sensitization to new allergens, and if given to patients with allergic rhinitis may even prevent the development of asthma. The effects caused by AIT may be visible for at least several years, even after the therapy has ended (Nakagome et al., 2021).
Imunoterapia cu alergeni în astmul alergic
Allergen immunotherapy in allergic asthma
First published: 21 decembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.4.2023.9257
Abstract
Rezumat
Imunoterapia cu alergeni (AIT) constă în administrarea repetată de alergeni cu scopul de a induce toleranţa imunologică. AIT cuprinde două subtipuri: imunoterapia subcutanată (SCIT) şi imunoterapia sublinguală (SLIT). Conform multiplelor studii efectuate, AIT ameliorează simptomele clinice, reduce hiperreactivitatea căilor respiratorii, îmbunătăţeşte controlul astmului şi reduce necesarul de corticosteroizi inhalatori (CSI). Adiţional, această terapie este capabilă să suprime sensibilizarea la noi alergeni, iar dacă este administrată pacienţilor cu rinită alergică, poate preveni chiar dezvoltarea astmului. Efectele determinate de AIT pot fi vizibile cel puţin câţiva ani, chiar şi după încheierea terapiei (Nakagome et al., 2021).
Introducere
Imunoterapia cu alergeni (AIT) este recomandată pacienţilor simptomatici cu sensibilizare IgE mediată şi constă în administrarea unor cantităţi crescânde de alergeni specifici cu scopul de a modula sistemul imunitar în vederea obţinerii toleranţei. AIT poate fi administrată pe mai multe căi: subcutanat, sublingual, oral, nazal, bronşic şi limfatic. În prezent sunt utilizate pe scară largă imunoterapia subcutanată (SCIT) şi imunoterapia sublinguală (SLIT) sub formă de picături sau de tablete. Imunoterapia este recomandată a fi administrată pacienţilor cu: rinită/rinoconjuctivită alergică moderat-severă intermitentă sau persistentă, în special la cei care nu răspund la tratamentul farmacologic, la cei care doresc să reducă sau să evite farmacoterapia pe termen lung şi potenţialele efecte adverse ale acesteia, cât şi la pacienţii cu astm alergic, dovedit a fi cauzat de un alergen bine definit, dacă astmul este controlat şi dacă VEMS1 este peste 70% (Zuberbier et al., 2010).
În cazul pacienţilor astmatici, se poate obţine un control al bolii prin administrarea corticosteroizilor inhalatori (CSI), dar această terapie este una simptomatică, nefiind capabilă să modifice istoria naturală a bolii, precum AIT. În plus, administrarea CSI nu aduce beneficii la pacienţii cu rinoconjunctivită alergică, care este adesea complicată la pacienţii astmatici. Astfel, AIT este singura terapie capabilă să inducă remisiunea imunologică pentru o varietate de boli alergice (Nakagome et al., 2021).
Primele date privind desensibilizarea sunt din 1911, când Lenonard Noon a administrat subcutanat cantităţi crescânde ale unui extract din polenul de Phleum pratense şi a obţinut reducerea simptomelor sezoniere ale rinitei şi ale astmului. La momentul respectiv, Noon susţinea că simptomele ar fi generate de o toxină solubilă din polenul de graminee, iar prin administrarea extractului se vor produce antitoxine. Ulterior, Walker a efectuat un studiu la pacienţi astmatici, susţinând rolul important al proteinelor, care, conform acestuia, proveneau din bacterii, alimente şi scuame de animal. Odată cu descoperirea imunoglobulinei E (IgE) în 1966, s-au obţinut progrese în ceea ce priveşte înţelegerea mecanismelor fiziopatologice ale afecţiunilor alergice şi înţelegerea eficacităţii acestui tratament (Incorvaia et al., 2019).
Mecanismul de acţiune al AIT
Primul răspuns la administrarea AIT constă în desensibilizarea rapidă a mastocitelor şi bazofilelor. Odată cu iniţierea dozelor terapeutice de alergeni, s-a observat o activitate scăzută a celulelor efectoare, care devin mai puţin reactive la proteinele din mediu. Este posibil ca aceste modificări să fie rezultatul eliberării de mediatori inflamatori în cantităţi mai mici decât pragul pentru anafilaxie sistemică şi ulterior să determine schimbarea pragului de activare al mastocitelor şi bazofilelor. Receptorul 2 al histaminei (HR2) suprimă selectiv bazofilele şi participă la toleranţa timpurie la alergeni. HR2 inhibă atât activitatea indusă de receptorii FcεRI, cât şi eliberarea de chemokine de către bazofile. Mastocitele pot contribui atât la rezistenţa înnăscută, cât şi la cea dobândită a gazdei, în timp ce IgE şi FcεRI sunt implicate în rezistenţa dobândită (Zhang et al., 2018).
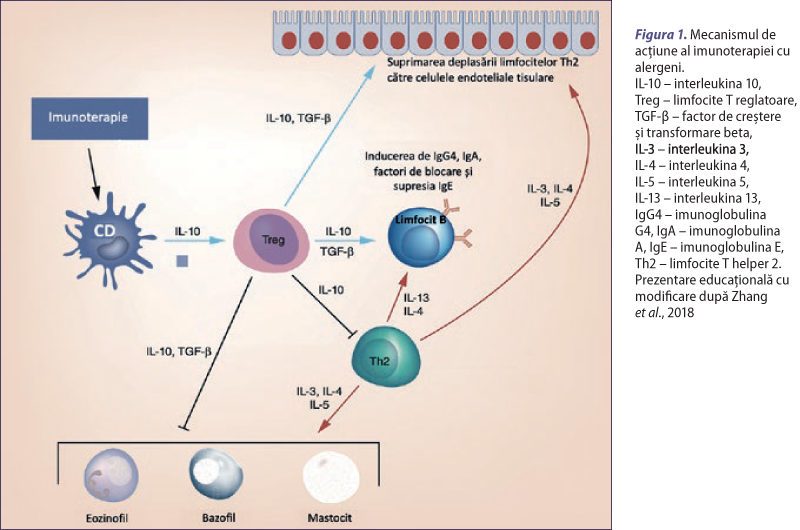
Activitatea limfocitelor T reglatoare (Treg) şi B reglatoare (Breg) este esenţială pentru funcţionarea normală a sistemului imunitar (James et al., 2011). Limfocitele Treg participă la suprimarea răspunsurilor imune de tip Th2. Echilibrul dintre celulele Th2 şi Treg este crucial pentru dezvoltarea sau suprimarea inflamaţiei alergice (figura 1). Limfocitele Treg şi Breg specifice antigenului au valori crescute atât după expunerea naturală la alergeni, cât şi după AIT. Odată activate, aceste limfocite secretă interleukina 10 (IL-10), citokină esenţială pentru inducerea toleranţei limfocitelor T. IL-10 induce toleranţă prin producerea de imunoglobuline G4 (IgG4) specifice antigenului. Pe parcursul imunoterapiei, nivelurile de IgG4 cresc, împiedicând alergenul să ajungă la IgE-urile de pe suprafaţa mastocitelor şi a bazofilelor. Pe lângă IL-10, există o serie de alţi factori implicaţi în inducerea toleranţei, printre care TGF-β şi antigenul 4 al limfocitelor T citotoxice. S-a observat că limfocitele Breg care secretă IL-10 au exprimate la suprafaţă niveluri ridicate de CD25 şi CD71 şi niveluri scăzute de CD73. Treg şi Breg secretă IL-10 şi TGF-β, care determină class-switch-ul limfocitelor B de la IgE la IgG4 şi IgA2. Anticorpii IgE serici cresc tranzitoriu în timpul AIT, dar ulterior scad treptat în decursul lunilor sau al anilor următori. Un alt aspect important obţinut prin administrarea de AIT este diminuarea răspunsului de fază târzie (LPR) în care sunt implicate eozinofilele şi limfocitele T. Această ipoteză este susţinută de studii care demonstrează modul în care nivelurile plasmatice reduse ale markerilor de activare ai eozinofilelor şi ai factorilor chemotactici pentru eozinofile şi neutrofile se corelează cu ameliorarea clinică. De asemenea, în timpul AIT se observă o scădere a hiperreactivităţii bronşice, nazale şi conjunctivale la stimuli nespecifici. Endotelina-1 plasmatică, un peptid bronhoconstrictor şi proinflamator, este semnificativ diminuată la copiii astmatici după imunoterapie (Van De Veen et al., 2013, Zhang et al., 2018).
Imunoterapia subcutanată în astmul alergic
Între anii 1970 şi 1990, s-au efectuat o serie de studii randomizate, controlate cu placebo, în ceea ce priveşte administrarea AIT pacienţilor cu astm, dar acestea au fost nesemnificative statistic, din cauza efectuării la loturi mici de pacienţi. Ulterior s-au realizat o serie de metaanalize care cuprindeau multiple studii în care a fost administrată imunoterapie pentru acarieni, polenuri, scuame de animal, mucegaiuri, latex, dar şi pentru alţi alergeni. În aceste metaanalize, prevalenţa studiilor privind acarienii din praful de casă reprezintă mai mult de jumătate, ceea ce reflectă importanţa clinică a acestora drept cauză a astmului (Miller, 2019; Incorvaia et al., 2019). Rezultatele au evidenţiat o diminuare a manifestărilor clinice, a hiperreactivităţii bronşice, precum şi a necesarului de medicaţie (Dhami et al., 2017). Prin administrarea SCIT cu acarienii din praful de casă la pacienţii sensibilizaţi la acarieni şi trataţi standard pentru astm, s-a observat o scădere a utilizării de β2-agonişti inhalatori şi o creştere a fluxului de vârf în astmul uşor-moderat (Maestrelli et al., 2004). Totodată, adăugarea SCIT la acarieni prin metoda rush la pacienţii cu astm alergic a redus doza de corticosteroizi inhalatori şi a inhibat producerea de IL-5 şi IL-13. Prin administrarea unui extract modificat care induce o etapă de depigmentare şi polimerizare cu glutaraldehidă şi absorbţie de hidroixid de aluminiu, s-au redus simptomele astmului şi s-au îmbunătăţit rezultatele testului de provocare bronşică (Nakagome et al., 2021). AIT determină control şi asupra altor afecţiuni alergice, precum rinoconjunctivita alergică, care este adesea complicată în astm (Nakagome et al., 2021). În cazul pacienţilor astmatici trebuie puse în aplicare aspecte cruciale, cum ar fi prezenţa şi cuantificarea în produsele de imunoterapie a tuturor alergenilor relevanţi din punct de vedere clinic şi administrarea unor doze adecvate de alergeni (Carnés et al., 2017; Larenas-Linnemann et al., 2016).
Imunoterapia sublinguală în astmul alergic
Conform unor studii, chiar dacă SLIT ar putea fi mai puţin eficientă decât SCIT (Chelladurai et al., 2013), este mai frecvent administrată datorită riscului scăzut de reacţii sistemice. La pacienţii cu astm alergic la care s-a administrat SLIT, s-au observat ameliorarea simptomelor astmului, îmbunătăţirea funcţiei respiratorii şi reducerea utilizării de bronhodilatatoare. Un studiu efectuat de Marogna et al. la pacienţi cu astm alergic şi rinită alergică a arătat că, după administrarea SLIT, s-au îmbunătăţit simptomele date de rinită, de astm şi a scăzut valoarea eozinofilelor nazale (Marogna et al., 2009). Sena et al. au raportat că vânzările din prescripţiile SLIT au scăzut de la 100% la 44% în primul an, la 28% în al doilea an şi la 13% în al treilea an, ceea ce sugerează că mai puţin de 20% continuau după trei ani (Senna et al., 2010). Astfel, una dintre principalele probleme legate de SLIT este complianţa la tratament.
AIT şi astmul necontrolat
În funcţie de severitatea astmului, AIT se recomandă a fi administrată pacienţilor cu astm alergic intermitent sau persistent, uşor până la moderat, controlat. Conform unui consens internaţional, prin administrarea de AIT la pacienţii cu astm necontrolat, apar reacţii foarte severe. De aceea, potrivit recomandărilor actuale, tratamentul cu AIT nu trebuie iniţiat la pacienţii cu simptome de astm necontrolat şi este necesară obţinerea iniţială a unui bun control. Potrivit unor studii, prin administrarea AIT la pacienţii cu astm sever controlat, s-ar obţine reducerea severităţii astmului, dar nu există date suficiente în literatura de specialitate, iar această afecţiune rămâne o contraindicaţie (Caimmi et al., 2022).
Biomarkeri ai eficienţei AIT
Conform EAACI, biomarkerii pentru eficienţa imunoterapiei au fost grupaţi în şapte domenii: IgE (IgE totale, IgE specifice şi raportul IgE specifice/IgE totale), subclasele IgG (IgG1 specifică alergenului şi IgG4 specific, inclusiv raportul IgE specific/IgG4), activitatea serică inhibitorie pentru IgE (evaluată prin testul IgE-FAB), activarea bazofilelor, citokinele şi chemokinele, markerii celulari (Tregs, Bregs şi celule dendritice) şi biomarkerii in vivo care includ teste de provocare (Shamji et al., 2017).
Pe parcursul tratamentului de desensibilizare se remarcă o creştere iniţială a nivelului de IgE totale şi specifice, care ulterior vor scădea treptat în următoarele etape ale tratamentului (Shamji et al., 2012). În timp ce valorile IgE totale scad treptat în timpul imunoterapiei, valorile IgG4 cresc treptat (Schulten et al., 2018; Ciepiela et al., 2014). Activitatea inhibitorie a IgE este evaluată prin testul IgE-FAB. Acesta măsoară capacitatea serului care conţine IgG (obţinut după imunoterapia cu alergen) de a inhiba legarea dependentă de FcεRII a complexelor alergen-IgE la celulele B, dar în prezent este limitat la laboratoarele specializate (Shamji et al., 2017). Pentru a determina activitatea bazofilelor, se verifică expresia markerilor de suprafaţă (CD63 şi CD203c) prin testare sangvină. CD63 indică degranularea bazofilelor, iar CD203c – activarea dependentă de IL-3 (Nakagome et al., 2021). AIT a fost asociată cu inhibarea activităţii bazofilelor, prin intermediul anticorpilor IgG specifici alergenului, care concurează cu IgE pentru legarea alergenului. Adiţional, complexele alergen-IgG pot acţiona prin declanşarea receptorilor IgG inhibitori FccRIIb de la suprafaţa bazofilelor, inhibând astfel activarea receptorilor IgE din aval (Wachholz et al., 2013; (Shamji et al., 2017). Un mecanism important în eficienţa terapiei este legat de trecerea de la un răspuns dominant de tip Th2 la un răspuns Th1. Consecinţa acestuia presupune o scădere a citokinelor Th2 (IL-4, IL-13, IL-9), a chemokinelor (IL-17, eotaxina sau TNF-α), urmată de creşterea citokinelor Th1 (IFN-γ, IL-12) şi a citokinelor reglatoare (IL-10, TGF-β). Inducerea toleranţei imunologice prin AIT se obţine prin producerea limfocitelor Treg şi Breg specifice. Un număr crescut de Treg în mucoasa nazală după AIT este asociat cu eficacitatea clinică şi cu suprimarea inflamaţiei alergice sezoniere. Un alt instrument util pentru verificarea eficacităţii sunt biomarkerii in vivo care includ testele de provocare. Acestea cuprind testele prick, testele intradermice, cât şi evaluarea organelor-ţintă prin test de provocare conjunctivală, nazală sau prin utilizarea camerelor de expunere ambientală (Shamji et al., 2017).
AIT în prevenirea astmului
Rinita alergică (RA) reprezintă un factor de risc important în apariţia astmului, atât la adulţi, cât şi la copii. Riscul este mai mare la pacienţii cu simptome severe, în cazul RA cu debut precoce şi la polisensibilizaţi (Gradman et al., 2021). Prin administrarea de AIT la pacienţii cu RA se obţine un efect de prevenire a astmului, prin întreruperea marşului atopic. În acest caz, majoritatea studiilor au fost efectuate în rândul copiilor cu rinită alergică sezonieră, iar efectele de prevenire au fost remarcate în special faţă de polenuri. Studiile observaţionale efectuate la toate grupele de vârstă au arătat un efect mai puternic de prevenire în cazul copiilor, comparativ cu adulţii. Cu toate acestea, există o limitare a dovezilor, din pricina studiilor eterogene efectuate la loturi mici de pacienţi. Nu se cunoaşte exact dacă există o prevenţie a astmului sau doar o încetinire de apariţie a acestuia. În studiile efectuate la pacienţii sensibilizaţi la acarienii din praful de casă, nu s-a obţinut un real beneficiu privind prevenirea astmului (Arshad, 2022). O altă analiză sistemică, din 2017, a arătat că, prin administrarea de AIT timp de trei ani, s-a redus semnificativ riscul de apariţie a astmului la pacienţii cu RA, în special la copii, la pacienţi monosensibilizaţi şi la AIT cu polen. Acest beneficiu s-a menţinut încă doi ani după terminarea terapiei, dar momentan nu sunt date suficiente pentru o menţinere pe o perioadă mai îndelungată. În viitor, este posibil ca indicaţiile pentru AIT să difere pentru copii şi adulţi. Copiii cu simptome uşoare prezente într‑un singur sezon sau doar în câteva sezoane ar avea cel mai mare potenţial de obţinere a unui efect de prevenire al astmului. Pe de altă parte, la adulţi, iniţierea ar trebui să se bazeze pe severitatea simptomelor (Gradman et al., 2021). Rezultate mai bune în prevenirea astmului s-au obţinut prin SCIT şi SLIT cu picături, acestea fiind evidente şi în cazul tabletelor, dar într-o măsură mai mică (Farraia et al., 2022).
AIT şi exacerbările din astm
Ghidul GINA recomandă, în cazul pacienţilor cu astm determinat de acarienii din praful de casă, administrarea suplimentară de AIT cu acarieni la terapia de control, cu scopul de a reduce numărul exacerbărilor. GINA recomandă, de asemenea, evaluarea controlului astmului, care include atât simptomele, cât şi riscul de viitoare efecte adverse (GINA 2023). Dhami şi colab. au evaluat şase studii şi au ajuns la concluzia că sunt dovezi limitate în reducerea exacerbărilor cu preparatele SLIT, în timp ce cu produsele SCIT nu s-a constat niciun efect privind exacerbările (Dhami et al., 2017). Conform EAACI, exacerbările sunt dificil de evaluat, din pricina ratei inconstante a acestora în populaţia-ţintă şi a răspunsului diferit în rândul populaţiei la intervenţii specifice (O’Byrne et al., 2018).
AIT şi funcţia pulmonară
Testele funcţionale pulmonare sunt utile pentru diagnosticul şi monitorizarea pacienţilor cu astm. Conform GINA 2023, înainte de iniţierea AIT se recomandă evaluarea funcţiei pulmonare pentru a identifica pacienţii eligibili, respectiv cei cu astm alergic sensibilizaţi la acarienii din praful de casă, cu VEMS1 (volumul expirator maxim pe secundă) > 70% din valoarea prezisă. În acest sens, spirometria este un test obiectiv şi reproductibil, util în evaluarea clinică iniţială şi în monitorizarea tratamentului. Metaanaliza lui Dhami şi colab. s-a concentrat pe evaluarea eficacităţii AIT în raport cu parametrii funcţiei pulmonare (Kappen et al., 2023). Astfel, s-a observat un efect pozitiv asupra căilor mici, respectiv FEF 25-75%, dar fără nicio îmbunătăţire clară a VEMS1 sau a PEF. O altă metaanaliză, realizată de Abramson et al., nu a pus în evidenţă modificări semnificative în cazul funcţiei pulmonare comparativ cu placebo. De aceea, pentru a verifica eficienţa terapiei asupra funcţiei pulmonare, se recomandă măsuri directe de verificare a funcţiei respiratorii ale căilor mici, precum oscilometria cu impulsuri (IOS) (Abramson et al., 2010).
AIT şi CSI
Pentru a menţine controlul astmului, pacienţilor li se administrează combinaţia dintre un corticosteroid inhalator şi un bronhodilatator. Asociat, se poate administra AIT, care participă, de asemenea, la îmbunătăţirea controlului astmului şi la reducerea exacerbărilor.
Virchow et al. au efectuat un studiu dublu-orb, controlat cu placebo, în care au urmărit intervalul de timp până la apariţia primei exacerbări, în cazul pacienţilor trataţi cu AIT la care se reduce/opreşte administrarea de CSI timp de şase luni. În concluzie, în cazul AIT acarieni SLIT, s-a observat o prelungire cu 9-10% a perioadei de apariţie a primei exacerbări pe parcursul celor şase luni. Un alt studiu, care a inclus pacienţi trataţi cu AIT acarieni comprimate, a avut criteriul principal de evaluare cea mai mică doză de CSI necesară pentru a menţine un control adecvat al astmului. Diferenţa în ceea ce priveşte scăderea dozei de ICS între tratamentul activ şi placebo la sfârşitul perioadei de evaluare a studiului a fost în favoarea grupului de tratament (Kappen et al., 2023). Potrivit unui studiu efectuat în rândul copiilor astmatici cu sensibilizare la acarieni, prin adăugarea SCIT la tratamentul de fond s-a dovedit o reducere a necesităţii de utilizare a CSI pentru a menţine controlul bolii, comparativ cu farmacoterapia singură (Zielen et al., 2010).
AIT asociată cu omalizumab
Această asociere între AIT şi omalizumab pare a fi o variantă promiţătoare pentru a creşte eficacitatea AIT. Studiul realizat de Bożek et al. s-a concentrat pe administrarea acestei combinaţii, care a determinat reducerea exacerbărilor astmatice şi a dozei zilnice de CSI. Una dintre principalele probleme ale acestei terapii este reprezentată de costurile ridicate. Este posibil ca evaluarea pe termen lung a eficacităţii tratamentului să reducă în viitor costul total. În studiul lui Bożek et al., s-a utilizat omalizumab în doză fixă, nefiind ajustat la greutatea corporală. Asocierea AIT cu o doză fixă de omalizumab poate reduce în mod favorabil doza de biologic şi, astfel, poate afecta costurile tratamentului (Bożek et al., 2023).
Kopp şi colab. au dovedit că omalizumab în combinaţie cu SCIT la pacienţii cu rinită alergică sezonieră şi/sau astm reduce simptomele mai mult decât SCIT singură (Kopp et al., 2013). Stelmach şi colab. au efectuat un studiu observaţional în care s-au axat pe urmărirea tratamentului de întreţinere cu omalizumab la copiii şi adolescenţii cu alergii la acarieni sau mucegai, diagnosticaţi cu astm sever, care nu au tolerat AIT înainte de iniţierea tratamentului cu omalizumab. Ulterior, cei mai mulţi dintre aceşti pacienţi au continuat cu succes AIT (Stelmach et al., 2015).
Massanari et al. au arătat că, la pacienţii adulţi cu diverse alergii, inclusiv la acarieni, tratamentul cu omalizumab iniţiat înainte de AIT a redus semnificativ simptomele astmului şi utilizarea de β-agonişti (Massanari et al., 2010).
Concluzii
AIT este în prezent o opţiune terapeutică consacrată pentru pacienţii atent selecţionaţi cu astm alergic. Beneficiile sunt legate de simptomele respiratorii, de exacerbări, de controlul astmului şi de necesarul de CSI. Atât SCIT, cât şi SLIT sunt două opţiuni sigure de AIT, dacă sunt administrate în mod corespunzător. Eficacitatea acestei terapii a fost dovedită la orice grupă de vârstă. AIT este capabilă să modifice evoluţia naturală a bolii alergice, prin modificarea marşului atopic, reducând riscul de apariţie a astmului la pacienţii care suferă de rinită alergică. În consecinţă, AIT este o terapie sigură, utilă atât în prevenirea astmului alergic, cât şi în tratarea lui (Caimmi et al., 2022).
Abrevieri
AIT – imunoterapie cu alergeni
CSI – corticosteroizi inhalatori
HR2 – receptorul 2 al histaminei
IgE – imunoglobulină E
IgG4 – imunoglobulină G4
IOS – oscilometrie cu impulsuri
IL-10 – interleukina 10
Limfocite Breg – limfocite B reglatoare
Limfocite Treg – T reglatoare
LPR – răspuns de fază târzie
RA – rinită alergică
SCIT – imunoterapie subcutanată
SLIT – imunoterapie sublinguală
TGF-β – factor de creştere şi transformare beta
VEMS – volum expirator maxim pe secundă
Autor corespondent:
Carmen Panaitescu
E-mail: cbunu@umft.ro
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Nakagome K, Nagata M. Role of Allergen Immunotherapy in Asthma Treatment and Asthma Development. Allergies. 2021;1:33-45. https://doi.org/10.3390/allergies1010003.
- Zuberbier T, Bachert C, Bousquet PJ, et al. GA² LEN/EAACI pocket guide for allergen-specific immunotherapy for allergic rhinitis and asthma. Allergy. 2010 Dec;65(12):1525-30. doi: 10.1111/j.1398-9995.2010.02474.x.
- Incorvaia C, Makri E, Ridolo E, Pellicelli I, Panella L. Advances in allergen immunotherapy as a treatment of asthma. Expert Rev Respir Med. 2019 Dec;13(12):1161-1167. doi: 10.1080/17476348.2019.1676153.
- Zhang W, Lin C, Sampath V, Nadeau K. Impact of allergen immunotherapy in allergic asthma. Immunotherapy. 2018 Jun;10(7):579-593. doi: 10.2217/imt-2017-0138.
- James LK, Shamji MH, Walker SM, Wilson DR, Wachholz PA, Francis JN, Jacobson MR, Kimber I, Till SJ, Durham SR. Long-term tolerance after allergen immunotherapy is accompanied by selective persistence of blocking antibodies. J Allergy Clin Immunol. 2011 Feb;127(2):509-516.e1-5. doi: 10.1016/j.jaci.2010.12.1080.
- Van de Veen W, Stanic B, Yaman G, Wawrzyniak M, Söllner S, Akdis DG, Rückert B, Akdis CA, Akdis M. IgG4 production is confined to human IL-10-producing regulatory B cells that suppress antigen-specific immune responses. J Allergy Clin Immunol. 2013 Apr;131(4):1204-12.
- Miller JD. The Role of Dust Mites in Allergy. Clin Rev Allergy Immunol. 2019 Dec;57(3):312-329. doi: 10.1007/s12016-018-8693-0.
- Dhami S, Kakourou A, Asamoah F, Agache I, Lau S, Jutel M, Muraro A, Roberts G, Akdis CA, Bonini M, Cavkaytar O, Flood B, Gajdanowicz P, Izuhara K, Kalayci Ö, Mosges R, Palomares O, Pfaar O, Smolinska S, Sokolowska M, Asaria M, Netuveli G, Zaman H, Akhlaq A, Sheikh A. Allergen immunotherapy for allergic asthma: A systematic review and meta-analysis. Allergy. 2017 Dec;72(12):1825-1848.
- Maestrelli P, Zanolla L, Pozzan M, Fabbri LM; Regione Veneto Study Group on the “Effect of immunotherapy in allergic asthma”. Effect of specific immunotherapy added to pharmacologic treatment and allergen avoidance in asthmatic patients allergic to house dust mite. J Allergy Clin Immunol. 2004 Apr;113(4):643-9.
- Carnés J, Iraola V, Cho SH, Esch RE. Mite allergen extracts and clinical practice. Ann Allergy Asthma Immunol. 2017 Mar;118(3):249-256. doi: 10.1016/j.anai.2016.08.018. 1.
- Larenas-Linnemann DE, Mösges R. Dosing of European sublingual immunotherapy maintenance solutions relative to monthly recommended dosing of subcutaneous immunotherapy. Allergy Asthma Proc. 2016 Jan-Feb;37(1):50-6. doi: 10.2500/aap.2016.37.3907.
- Chelladurai Y, Suarez-Cuervo C, Erekosima N, Kim JM, Ramanathan M, Segal JB, Lin SY. Effectiveness of subcutaneous versus sublingual immunotherapy for the treatment of allergic rhinoconjunctivitis and asthma: a systematic review. J Allergy Clin Immunol Pract. 2013 Jul-Aug;1(4):361-9.
- Marogna M, Spadolini I, Massolo A, Berra D, Zanon P, Chiodini E, Canonica GW, Passalacqua G. Long-term comparison of sublingual immunotherapy vs inhaled budesonide in patients with mild persistent asthma due to grass pollen. Ann Allergy Asthma Immunol. 2009 Jan;102(1):69-75.
- Senna G, Lombardi C, Canonica GW, Passalacqua G. How adherent to sublingual immunotherapy prescriptions are patients? The manufacturers’ viewpoint. J Allergy Clin Immunol. 2010 Sep;126(3):668-9.
- Caimmi D, Demoly P. A review of allergen immunotherapy in asthma. Allergy Asthma Proc. 2022 Jul 1;43(4):310-313. doi: 10.2500/aap.2022.43.210113.
- Shamji MH, Kappen JH, Akdis M, Jensen-Jarolim E, Knol EF, Kleine-Tebbe J, Bohle B, Chaker AM, Till SJ, Valenta R, Poulsen LK, Calderon MA, Demoly P, Pfaar O, Jacobsen L, Durham SR, Schmidt-Weber CB. Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper. Allergy. 2017 Aug;72(8):1156-1173.
- Shamji MH, Durham SR. Mechanisms of allergen immunotherapy for inhaled allergens and predictive biomarkers. J Allergy Clin Immunol. 2017 Dec;140(6):1485-1498.
- Shamji MH, Ljørring C, Francis JN, Calderon MA, Larché M, Kimber I, Frew AJ, Ipsen H, Lund K, Würtzen PA, Durham SR. Functional rather than immunoreactive levels of IgG4 correlate closely with clinical response to grass pollen immunotherapy. Allergy. 2012 Feb;67(2):217-26.
- Schulten V, Tripple V, Seumois G, Qian Y, Scheuermann RH, Fu Z, Locci M, Rosales S, Vijayanand P, Sette A, Alam R, Crotty S, Peters B. Allergen-specific immunotherapy modulates the balance of circulating Tfh and Tfr cells. J Allergy Clin Immunol. 2018 Feb;141(2):775-777.e6.
- Ciepiela O, Zawadzka-Krajewska A, Kotuła I, van Overveld F, Kulus M, Demkow U. Sublingual Immunotherapy for Asthma: Affects T-Cells but Does not Impact Basophil Activation. Pediatr Allergy Immunol Pulmonol. 2014 Mar 1;27(1):17-23.
- Shamji MH, Kappen JH, Akdis M, Jensen-Jarolim E, Knol EF, Kleine-Tebbe J, Bohle B, Chaker AM, Till SJ, Valenta R, Poulsen LK, Calderon MA, Demoly P, Pfaar O, Jacobsen L, Durham SR, Schmidt-Weber CB. Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper. Allergy. 2017 Aug;72(8):1156-1173. doi: 10.1111/all.13138.
- Wachholz PA, Soni NK, Till SJ, Durham SR. Inhibition of allergen-IgE binding to B cells by IgG antibodies after grass pollen immunotherapy. J Allergy Clin Immunol. 2003 Nov;112(5):915-22.
- Gradman J, Halken S. Preventive Effect of Allergen Immunotherapy on Asthma and New Sensitizations. J Allergy Clin Immunol Pract. 2021 May;9(5):1813-1817. doi: 10.1016/j.jaip.2021.03.010.
- Arshad SH. Does allergen immunotherapy for allergic rhinitis prevent asthma? Ann Allergy Asthma Immunol. 2022 Sep;129(3):286-291. doi: 10.1016/j.anai.2022.04.028.
- Farraia M, Paciência I, Castro Mendes F, Cavaleiro Rufo J, Shamji M, Agache I, Moreira A. Allergen immunotherapy for asthma prevention: A systematic review and meta-analysis of randomized and non-randomized controlled studies. Allergy. 2022 Jun;77(6):1719-1735. doi: 10.1111/all.15295.
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023.
- O’Byrne PM, FitzGerald JM, Bateman ED, et al. Inhaled combined budesonide-formoterol as needed in mild asthma. N Engl J Med. 2018;378(20):1865-1876.
- Kappen J, Diamant Z, Agache I, Bonini M, Bousquet J, Canonica GW, Durham SR, Guibas GV, Hamelmann E, Jutel M, Papadopoulos NG, Roberts G, Shamji MH, Zieglmayer P, Gerth van Wijk R, Pfaar O. Standardization of clinical outcomes used in allergen immunotherapy in allergic asthma: An EAACI position paper. Allergy. 2023 Nov;78(11):2835-2850. doi: 10.1111/all.15817.
- Abramson MJ, Puy RM, Weiner JM. Injection allergen immunotherapy for asthma. Cochrane Database Syst Rev. 2010;(8):CD001186.
- Wang L, Yin J, Fadel R, Montagut A, de Beaumont O, Devillier P. House dust mite sublingual immunotherapy is safe and ap- pears to be effective in moderate, persistent asthma. Allergy. 2014;69(9):1181-1188.
- Zielen S, Kardos P, Madonini E. Steroid-sparing effects with allergen- specific immunotherapy in children with asthma: a randomized controlled trial. J Allergy Clin Immunol. 2010;126(5):942-949.
- Bożek A, Fischer A, Bogacz-Piaseczynska A, Canonica GW. Adding a biologic to allergen immunotherapy increases treatment efficacy. ERJ Open Res. 2023 Apr 17;9(2):00639-2022. doi: 10.1183/23120541.00639-2022. 3.
- Kopp MV, Hamelmann E, Bendiks M, Zielen S, Kamin W, Bergmann KC, Klein C, Wahn U; DUAL Study Group. Transient impact of omalizumab in pollen allergic patients undergoing specific immunotherapy. Pediatr Allergy Immunol. 2013 Aug;24(5):427-33.
- Stelmach I, Majak P, Jerzyńska J, Bojo M, Cichalewski Ł, Smejda K. Children with severe asthma can start allergen immunotherapy after controlling asthma with omalizumab: a case series from Poland. Arch Med Sci. 2015 Aug 12;11(4):901-4.
- Massanari M, Nelson H, Casale T, Busse W, Kianifard F, Geba GP, Zeldin RK. Effect of pretreatment with omalizumab on the tolerability of specific immunotherapy in allergic asthma. J Allergy Clin Immunol. 2010 Feb;125(2):383-9.
Articole din ediţiile anterioare
Alergia la veninul de himenoptere
Alergia la veninul de himenoptere este o reacţie alergică ce poate pune viaţa în pericol în urma unei înţepături de albine, viespe sau furnică. Rea...
Sindromul polen-alimente (PFAS)
Alergiile sunt întâlnite în populaţie în proporţie de 20-30%, cele mai frecvente fiind cele respiratorii, determinate de polenul arborilor şi al pl...
Omalizumab în alergiile alimentare – perspectivă terapeutică
Imunoglobulina E (IgE) joacă un rol central în patogeneza bolilor alergice, inclusiv în astm şi alergii alimentare(1). Terapia cu anticorpi monoclo...
Relevanţa clinică a profilinelor în bolile alergice
Profilinele sunt proteine care leagă actina, având rol în organizarea citoscheletului. Acestea sunt prezente în citoplasma tuturor celulelor eucari...