Interferons α (2a and 2b) are glycoproteins whose main indications are the treatment of chronic hepatitis C and melanoma. IFNs have the potential to induce a particular subset of adverse reaction due to their structural resemblance, but also their differences to the endogenous IFN α. IFN α (2a and 2b) can cause localized (injection site) or generalized cutaneous reactions, which represent about 5-12% of the total adverse reactions to this class. So far, the exact pathogenesis of the hypersensitivity reactions (HSR) to IFN α remains largely unknown, although several authors have tried to explain and demonstrate the mechanisms of these reactions, with more or less success. The management of HSR is guided mostly by the evaluation of the initial clinical severity, thus the treatment with INF α can be either permanently stopped, in case of a severe reaction, or continued in case of a mild reaction, especially if the medication is essential and a standardized desensitization protocol is available.
Purpose of the paper. To perform a review of the literature regarding HSR to IFN α, an area where literature data are scarce. The paper proposes to focus on delayed hypersensitivity reactions (DHR) to IFN α and their management.
Materials and method. Theoretical notions including expert´s opinion on DHR, their management and recommendation for desensitization will be discussed.
Results. The theoretical part will by illustrated by the means of a case presentation.
Conclusions. The clinical decision for the management of DHR to IFN α is based on multiple factors, such as the type of reactions, its severity, and patient-dependent factors such as the disease to be treated with IFN α. Choosing a solution can sometimes prove to be a very difficult task, especially if standardized, reliable desensitization protocols for the culprit drug are not available.
Managementul reacţiilor de hipersensibilitate întârziată (RHI) la interferonul alfa (IFN α)
Management of delayed hypersensitivity reactions to IFN α
First published: 01 martie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.2.1.2018.1472
Abstract
Rezumat
Interferonul (IFN) α 2a şi 2b se utilizează în tratamentul hepatitei cronice cu virus C şi al melanomului. Din cauza similitudinii structurale cu IFN-ul α endogen, dar şi deosebirilor faţă de acesta, IFN-ul α recombinant, ca citokină (medicaţie biologică), poate genera o serie de reacţii adverse deosebite de cele produse de medicaţia obişnuită. Reacţiile cutanate localizate sau generalizate, secundare expunerii la IFN α 2a şi 2b, reprezintă 5-12% din totalul reacţiilor adverse produse de această clasă de medicamente. În cazul reacţiilor adverse de hipersensibilitate (RHS) la IFN α (2a şi 2b), mecanismul nu este în totalitate cunoscut. Atitudinea terapeutică poate fi: a) de sistare a terapiei, cu înlocuirea medicaţiei sau, în cazul în care beneficiile acesteia depăşesc riscurile, iar reacţia nu este una severă, b) de continuare a terapiei sub tratament simptomatic sau utilizând un protocol de desensibilizare.
Scopul lucrării. Prezentarea îşi propune să realizeze o revizuire atentă a literaturii privind RHS la IFN α, cu accent asupra celor întârziate şi asupra recomandărilor de management al acestora.
Materiale şi metodă. Noţiuni teoretice, inclusiv opinia experţilor EAACI privind desensibilizarea în cazul RHI, un subiect rareori abordat, vor fi descrise.
Rezultate. Conceptele discutate în partea teoretică se vor regăsi ilustrate printr-un caz clinic.
Concluzii. Conduita în cazul RHI la IFN-ul α depinde de tipul reacţiei, de severitatea ei şi de particularităţile afecţiunii de bază şi ale pacientului. Alegerea unei soluţii se poate dovedi extrem de dificilă, mai ales în cazul în care nu există varianta unui protocol de desensibilizare standardizat.
Introducere
Interferonul (IFN) α 2a şi 2b se utilizează în tratamentul hepatitei cronice cu virus C şi al melanomului. Din punct de vedere structural, IFN-ul α 2a şi 2b sunt (glico)proteine obţinute prin tehnologie ADN recombinantă, a căror secvenţă de aminoacizi este identică cu cea a IFN-ului α uman, o citokină cu rol în răspunsul fiziologic antiviral şi în orchestrarea unor patologii autoimune (lupus eritematos sistemic - LES, dermatomiozită, diabet zaharat). Glicozilarea moleculei este diferită de cea a IFN-ului endogen(1). Datorită similitudinii structurale cu IFN-ul α endogen, dar şi deosebirilor faţă de acesta, IFN-ul α recombinant, ca citokină (medicaţie biologică), poate genera o serie de reacţii adverse deosebite de cele produse de moleculele xenobiotice. Formele pegylate pot produce reacţii adverse într-un procent de până la 48% din pacienţii trataţi(2). Reacţiile cutanate localizate sau generalizate, secundare expunerii la IFN α 2a şi 2b, reprezintă 5-12% din totalul reacţiilor adverse(3). În cazul reacţiilor adverse de hipersensibiliate la IFN α, mecanismul nu este în totalitate cunoscut(2,4). Atitudinea terapeutică în faţa acestor reacţii poate îmbrăca mai multe forme: a) atunci când reacţia este severă şi riscurile continuării tratamentului depăşesc beneficiile, se poate recurge la sistarea terapiei cu înlocuirea medicaţiei (dacă există alternativă); b) atunci când reacţia nu este una severă, iar beneficiile depăşesc riscurile, se poate decide continuarea terapiei sub tratament simptomatic(5) sau utilizând un protocol de desensibilizare. Lucrarea de faţă îşi propune să trateze situaţia particulară a reacţiilor de hipersensibilitate întârziată la IFN-ul α şi managementul acestora.
Clasificarea reacţiilor adverse la medicaţia biologică
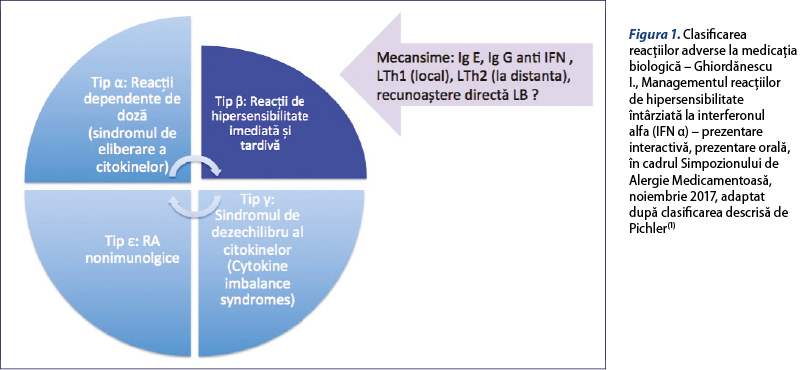
Potrivit lui Pichler(1), reacţiile adverse la medicaţia biologică se clasifică în (figura 1):
- Reacţii de tip α, care sunt reacţii dependente de doză (sindromul de eliberare a citokinelor), ce „simulează“ o descărcare masivă de citokine şi apar secundar expunerii sistemice la doze crescute de IFN α, necesare pentru a se putea atinge o concentraţie locală terapeutică calculată. Manifestare clinică: simptome sugestive pentru o infecţie virală (mialgie, artralgie, febră).
- Reacţii de tip β sau reacţii de hipersensibilitate imediată şi tardivă. Deşi mecanismul acestor reacţii nu a fost foarte clar demonstrat, se pare că marea majoritate sunt mediate de către anticorpi de tip IgE, IgG, limfocite Th1 şi Th2(2,6). De asemenea, recunoaşterea directă de către limfocitele B a fost descrisă(6). Manifestare clinică: urticarie, exantem maculopapulos, reacţie locală eczematoasă etc.
- Reactii de tip γ, „cytokine imbalance syndrome“, ce apar ca urmare a efectelor sistemice ale citokinelor, care pot produce dezechilibre imunologice ce pot sta la baza unor fenomene de autoimunitate sau autoinflamatorii. Manifestare clinică: trombocitopenie autoimună, anemie hemolitică autoimună, nefropatie cu IgA, LES, psoriazis, vitiligo etc.
- Reacţii de tip δ sau cross-reactivitate. Sunt caracteristice anticorpilor – de exemplu, cetuximab. Nu sunt descrise pentru IFN-ul α.
- Reacţii de tip ε sau efecte nonimunologice. Manifestare clinică: reacţii adverse neuropsihiatrice (stări confuzionale, depresie).
În cazul IFN-ului α sunt descrise: reacţii dependente de doză, „cytokine imbalance syndrome“, reacţii de hipersensibilitate (imediată şi tardivă) şi reacţii nonimunologice.
Aşa cum a fost menţionat, din punctul de vedere al aspectului clinic, reacţiile de hipersensibilitate întârziată/tardivă (RHI) la IFN-ul α 2a şi 2b pot fi clasificate ca:
Reacţii locale eczematoase.
Reacţii generalizate, care îmbracă, cel mai frecvent, forma de exantem maculopapulos, sau reacţii eczematoase generalizate(3).
Conduita terapeutică, în cazul reacţiilor de hipersensibilitate tardivă la IFN-ul α, este dictată de o multitudine de factori, cum ar fi: severitatea reacţiei de hipersensibilitate, severitatea afecţiunii care necesită tratament cu IFN, necesitatea continuării tratamentului/existenţa unei alternative terapeutice, posibilitatea investigării mecanismului reacţiei, existenţa unor protocoale de desensibilizare standardizate, experienţa medicului etc.

Toate reacţiile de hipersensibilitate trebuie evaluate din punct de vedere al severităţii şi, după caz, tratate până la stabilizare. Într-un al doilea pas, se poate alege una dintre variantele (figura 2):
1. În cazul în care reacţia este severă, riscurile tratamentului depăşesc beneficiile continuării acestuia şi/sau o alternativă terapeutică există, se poate decide sistarea permanentă a administrării IFN-ului α.
2. În cazul în care reacţia este uşoară/moderată, beneficiile continuării tratamentului sunt mai mari decât riscurile, iar afecţiunea de bază permite, se poate decide sistarea temporară a tratamentului cu IFN α, 4-6 săptămâni de la episodul acut, cu efectuarea ulterioară de teste alergologice(7). După notarea rezultatului testării alergologice, o nouă decizie se impune:
- Dacă testarea este pozitivă, se pot decide:
- Sistarea completă a tratamentului. Această variantă este indicată în special atunci când există alternativă terapeutică, sau
- Reluarea administrării de IFN α utilizând un protocol de desensibilizare. Această variantă este indicată în special în cazul în care nu există alternativă terapeutică.
- Dacă testarea este negativă, se pot decide:
- Reluarea directă a administrării de IFN α, sub strictă supraveghere medicală. N.B.: În caz de repetare a reacţiei de hipersensibilitate, în ciuda unui rezultat negativ la testare, se poate încerca o abordare de tip a) sau b)., sau
- Dacă există suspiciune clinică crescută de reacţie de hipersensibilitate, în ciuda unui rezultat negativ la testare, administrarea IFN α utilizând un protocol de desensibilizare.
3. „Treating through“, concept care reprezintă continuarea tratamentului în prezenţa unei reacţii de hipersensibilitate medicamentoasă în desfăşurare (în curs de dezvoltare sau instalată), uneori sub medicaţie antialergică, cum ar fi corticosteroizii şi antihistaminicele, cu sau fără reducerea dozelor de IFN α.
4. În cazul în care reacţia este una uşoară/medie şi/sau beneficiile continuării tratamentului sunt mai mari decât riscurile, şi/sau nu există alternativă terapeutică, şi/sau afecţiunea de bază nu permite întreruperea tratamentului, se poate decide, imediat după stabilizarea reacţiei, reluarea tratamentului cu IFN α, utilizând un protocol de desensibilizare.
Testarea cutanată alergologică
Testările cutanate patch, cu citire la 48 şi 72 de ore, prick şi intradermice, cu citire imediată şi la 24-48-72 şi 96 de ore, se efectuează la 4-6 săptămâni de la episodul acut(7). Concentraţiile utilizate în diverse publicaţii sunt, de obicei, în acord cu recomandările generale ale EAACI(8,2), deşi nu există o valoare maximă noniritativă descrisă. Acest lucru se datorează, probabil, numărului scăzut de cazuri raportate în literatură. Testarea cutanată prick se efectuează cu IFN α injectabil, nediluat (concentraţie terapeutică). În cazul testării intradermice, nu există un consens clar; în mare, însă, concentraţiile utilizate rezultă din diluţii progresive, pornind de la 10-3(9) sau 10-2(3) din concentraţia iniţială şi finalizând cu forma pură a diferitelor preparate de IFN α: PEG-IFN α 2a (3,6-360 µg/mL), PEG-IFN α 2b (0,001‑0,1 mg/mL), IFN α 2a (0,03-0,3 MUI/mL), IFN α 2b (0,06‑6 MUI/mL). Cantitatea injectată i.d. este de 0,03‑0,05 ml. Controlul negativ şi cel pozitiv sunt reprezentate de soluţia salină şi, respectiv, histamina fosfat (10 mg/mL).
În ceea ce priveşte testarea cutanată patch, informaţiile sunt şi mai puţin concordante. Astfel, după unii autori(2), 0,03-0,05 ml din medicaţia nediluată, aplicată pe hârtie de filtru în camere Finn (12 mm; Epitest Ltd., Tuusula, Finlanda) reprezintă varianta preferată, în timp ce alţi autori aplică medicaţia pură în 30% vaselină (petrolatum), în camere IQ (Chemotechnique, Vellinge, Suedia)(3).
Este însă important de menţionat că sensibilitatea şi valoarea predictivă ale acestor teste sunt scăzute pentru reacţiile intârziate(10) şi necunoscute pentru IFN(3). După unii autori, utilitatea testării cutanate alergologice în cazul IFN-ului este discutabilă, întrucât, în ciuda unui istoric pozitiv, toate/aproape toate testările raportate au rezultat negativ(11). Testarea cutanată efecuată secundar unui protocol de desensibilizare, în cazul în care nu există o evaluare iniţială care să permită comparaţia, are relevanţă clinică necunoscută.
Testarea cutanată poate ghida înlocuirea cu o alternativă terapeutică.
N.B.: Riscul de cross-reactivitate între diversele tipuri de IFN α (2a si 2b) este de aproximativ 50%(3).
Aparent, forma nepegylată poate reprezenta o alternativă la forma pegylată în cazul pacienţilor cu hepatită cu virus C care dezvoltă o reacţie de hipersensibilitate la forma pegylată a IFN‑ului α, întrucât a fost postulat că molecula de polietilen glicol (PEG) are proprietăţi imunogene(2). În cazul tratamentului melanomului cu invazia ganglionilor locali se pot folosi atât forma nepegylată a IFN-ului α 2b, cât şi cea pegylată, care momentan însă nu este disponibilă în România în cadrul Programului naţional de tratament al melanomului.
„Treating through“ se indică atunci când medicaţia nu poate fi oprită şi beneficiile continuării tratamentului depăşesc riscurile(10). Această variantă este mai adecvată tratamentelor de scurtă durată, întrucât reacţiile adverse, generate de medicaţia utilizată pentru a trata reacţia de hipersensibilitate, pot contrabalansa beneficiile continuării tratamentului. În literatură sunt descrise: utilizarea corticosteroizilor administraţi sistemic sau local, a inhibitorilor de calcineurină locali şi a anthistaminicelor (cu indicaţie incertă în cazul reacţiilor de hipersensibilitate întârziată) pentru tratamentul reacţiilor de hipersensibilitate, cu rezultate variabile. Perioada de administrare a medicaţiei antialergice este departe de fi standardizată.
Desensibilizarea
Conform lui Scherer şi colaboratorilor săi(10), în cazul RHI se indică desensibilizare în următoarele situaţii:
- Atunci când tratamentul este esenţial (linia întîi de tratament; conform studiilor, medicaţia creşte supravieţuirea în cazul unei anumite patologii etc.).
- Atunci când medicaţia nu poate fi înlocuită, sau este mai eficientă decât alternativele terapeutice, sau are un mecanism de acţiune unic.
- Atunci când nu există medicaţie noncross-reactivă, care să permită înlocuirea.
- Atunci când reacţia de hipersensibilitate este uşoară şi bine documentată, eventual cu demonstrarea mecanismului prin evaluare alergologică.
- Atunci când riscul continuării tratamentului este mai mic decât beneficiul.
- Existenţa unui protocol standardizat de desensibilizare, dar şi experienţa personalului medical sunt, de asemenea, amănunte de luat în considerare înainte de a se opta pentru o astfel de abordare.
Diferite variante pentru protocoalele de desensibilizare în cazul reacţiilor de hipersensibilitate întârziate sunt descrise în literatură. Între acestea, există însă o variaţie majoră în ceea ce priveşte regimul de creştere a dozelor (rush: ore până la două zile până la atingerea concentraţiei terapeutice versus standard, două zile până la câteva săptămâni)(10), calea de administrare, intervalul dintre doze, numărul de zile necesare pentru a atinge concentraţia terapeutică şi utilizarea premedicaţiei(3,10).
În ciuda eforturilor făcute pentru a se standardiza conduita terapeutică în cazul RHI, este de subliniat că nu există o variantă unică de abordare. Deciziile iniţiale pot fi reconsiderate în funcţie de numeroşi factori, între care – şi poate cei mai importanţi – sunt evoluţia clinică a pacienţilor şi particularităţile afecţiunii de bază. Testarea alergologică poate orienta atitudinea terapeutică, dar nu are valoare absolută, mai ales în cazul reacţiilor tardive. Alegerea finală îi revine personalului medical, care trebuie să cântărească atent datele în vederea elaborării unor soluţii personalizate, adaptate nevoilor fiecărui pacient în parte.
În loc de concluzii
Pentru a exemplifica complexitatea factorilor ce influenţează decizia medicală în RHI, prezentăm cazul unui pacient de sex masculin, în vârstă de 48 de ani, diagnosticat cu limfadenopatie inghinală rezecată, cu examen histopatologic pozitiv de melanom malign. Cu patru zile anterior prezentării la secţia de alergologie, la acest pacient s-a iniţiat tratament adjuvant cu IFN α 2b nepegylat, în doză mare, i.v. 20 mU/m2, cu indicaţie de continuare a administrării 5 zile pe săptămână în primele 4 săptămâni şi ulterior de trei ori pe săptămână pe o perioadă de un an. La momentul respectiv, în octombrie 2016, IFN α 2b reprezenta singura opţiune terapeutică. În a patra zi de la iniţierea IFN-ului α 2b, la 7 ore de la administrarea ultimei doze, pacientul a dezvoltat o erupţie de tip exantem maculopapulos eritematos (EMP) la nivel abdominal, pe flancuri, treimea inferioară a toracelui posterior şi membrele inferioare (coapse şi gambe). Clinic, nu au fost decelate hepatosplenomegalie şi nici modificări cardiovasculare sau respiratorii. Paraclinic, nu s-au evidenţiat fenomene de hepatocitoliză sau insuficienţă renală. În cadrul evaluării opţiunilor terapeutice, s-a efectuat şi o investigare atentă a cazuisticii raportate în literatură, care a relevat un număr extrem de redus de publicaţii despre RHI la IFN-ul α 2b şi managementul acestora. Decizia finală, după o consultare extensivă cu colegii oncologi, a fost de tratament al reacţiei acute până la stabilizare şi de reluare imediată a administrării de IFN α 2b, utilizând un protocol de desensibilizare, creat de către membrii departamentul de alergologie al Spitalului „Elias“, în conformitate cu recomandările existente(10). Protocolul a permis atingerea dozei terapeutice după 5 zile de la iniţiere (figura 3). Nu s-a efectuat premedicaţie anterior aplicării protocolului.

Reacţia acută s-a remis complet, iar ulterior, în contextul iniţierii şi menţinerii protocolului de desensibilizare, nu s-au mai înregistrat fenomene sugestive pentru un mecanism de RHI. Motivele care au stat la baza conduitei terapeutice au fost: prezenţa unei afecţiuni maligne la un pacient tânăr, cu unică opţiune terapeutică, respectiv IFN‑ul α 2b nepegylat, posibil responsabil de dezvoltarea unui EMP (RHI, formă uşoară), dar cu indicaţie de continuare a acestuia, fără întrerupere pe o perioadă de un an, fără indicaţie de „treating through“, datorită duratei lungi planificate pentru administrarea IFN-ului. Testarea alergologică a fost amânată/omisă în urma opţiunii echipei medicale de a nu temporiza (4-6 săptămâni) reluarea tratamentului cu IFN α, dat fiind caracterul malign al afecţiunii acestui pacient. Evident, o astfel de abordare nu permite o potenţială confirmare imediată a reacţiei de hipersensibilitate şi, ca urmare, întrebările pe care autorii ar dori să vi le pună, în final, întrucât subiectul rămâne deschis, sunt: „Există o altă modalitate de management (sunt incluse şi inovaţiile originale) pe care aţi prefera-o în situaţia prezentată? Dacă da, care ar fi aceea?“.
Bibliografie
- W.J Pichler, Adverse side-effects to biological agents, Allergy. 2006 Aug; 61(8):912-20, DOI:10.1111/j.1398-9995.2006.01058.x
- S. Meller, P. A. Gerber, A. Kislat, P. Hevezi, T. Göbel, U. Wiesner, S. Kellermann, E. Bünemann, A. Zlotnik, D. Häussinger, A. Erhardt & B. Homey, Allergic sensitization to pegylated interferon-a results in drug eruptions, Allergy 2015 Jul;70(7):775–783, DOI: 10.1111/all.12618
- C. Poreaux, J.-P. Bronowicki, M. Debouverie, J.-L. Schmutz, J. Waton and A. Barbaud, Managing generalized interferon-induced eruptions and the effectiveness of desensitization, Clin Exp Allergy 2013;44: 756–764, doi: 10.1111/cea.12217
- Tavakoli-Tabasi S, Bagree A. A longitudinal cohort study of mucocutaneous drug eruptions during interferon and ribavirin treatment of hepatitis C. J Clin Gastroenterol 2012;46:162–167.
- I. Sidiropoulos, Hypersensitivity Reactions to Interferon Based Treatment for Hepatitis C: A Single Center 20-Year Experience, WAO Journal 2012 feb, Abstracts of the XXII World Allergy Congress, 4–8 December, 2011 Cancun, Mexico
- D.B. Beckman, T.L. Mathisen, K.E. Harris, M.B. Boxer, L.C. Grammer, Hypersensitivity to IFN-a. Allergy 2001 Aug;56(8): 806–807, DOI: 10.1034/j.1398-9995.2001.056008806.x
- Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, Khan DA, Lang DM, Park HS, Pichler W, Sanchez-Borges M, Shiohara T, Thong BY., International Consensus on drug allergy, Allergy. 2014 Apr;69(4):420-37, DOI:10.1111/all.12350
- Brockow K, Romano A, Blanca M, Ring J, Pichler W, Demoly P. General considerations for skin test procedures in the diagnosis of drug hypersensitivity. Allergy 2002; 57:45–51.
- P Barreira, S Cadinha, D Malheiro, JP Moreira da Silva, Delayed Hypersensitivity to Ribavirin Confirmed by Provocation Test, J Investig Allergol Clin Immunol 2014; Vol. 24(6): 439-462.
- Scherer K, Brockow K, Aberer W, Gooi JH, Demoly P, Romano A, Schnyder B, Whitaker P, Cernadas JS, Bircher AJ; ENDA, the European Network on Drug Allergy and the EAACI Drug Allergy Interest Group, Desensitization in delayed drug hypersensitivity reactions – an EAACI position paper of the Drug Allergy Interest Group, Allergy. 2013 Jul;68(7):844-52. doi: 10.1111/all.12161.
- M Corominas, G Gastaminza, T Lobera, Hypersensitivity Reactions to Biological Drugs, J Investig Allergol Clin Immunol 2014; Vol. 24(4): 212-225.
Articole din ediţiile anterioare
Desensibilizarea la aspirină – când şi cum?
Aspirina (acidul acetilsalicilic) este una dintre cele mai utilizate terapii din lume. Administrată în doză mică (75-150 mg), aspirina are propriet...
Sindromul de hipersensibilitate sau sindromul DRESS indus de anticonvulsivante
Introducere. Sindromul de hipersensibilitate indus de anticonvulsivante (SHA)/DRESS indus de anticonvulsivante (AC) este o reacție adversă rară, se...
Tratamentul astmului alergic – noi perspective şi abordări terapeutice
Astmul este o afecţiune eterogenă, caracterizată prin inflamaţia cronică a căilor respiratorii şi definită printr‑un istoric de simptome respirator...
Reacţii de hipersensibilitate induse de sulfonamide nonantibiotice – prezentare de caz clinic
Această lucrare aduce în prim-plan, pornind de la prezentarea de caz a unei paciente, reacţiile de hipersensibilitate la sulfonamidele nonantibioti...