Statins constitute the first-line medication in the primary and secondary prevention of cardiovascular accidents in patients with hypercholesterolemia, reducing by 25-30% the risk of myocardial infarction, ischemic stroke and cardiovascular lethality. Clinical studies over the past 10-15 years have demonstrated the likelihood of developing de novo diabetes after statin use. From these considerations, a series of problems are addressed, such as: Is the diabetogenic effect specific to the class of statins?; Does it depend on the dose used?; What is the benefit/risk ratio?; Which patients are more prone to developing diabetes?; what are the mechanisms of diabetes development?; Are there needed or developed diabetes prevention strategies for statin treatment?; Is it necessary to change the tactics of using statins in the development of diabetes?
Statinele şi efectul diabetogen (II)
Statins and the diabetogenic effect (II)
First published: 31 octombrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.208.5.2022.7144
Abstract
Rezumat
Statinele constituie medicaţia de primă linie în profilaxia primară şi secundară a accidentelor cardiovasculare la pacienţii cu hipercolesterolemie, prin reducerea cu 25-30% a riscului de infarct miocardic, a ictusului ischemic şi a letalităţii cardiovasculare. Studiile clinice din ultimii 10-15 ani au demonstrat probabilitatea dezvoltării diabetului zaharat de novo după utilizarea statinelor. Din aceste considerente, sunt abordate o serie de probleme, precum: este efectul diabetogen specific clasei statinelor?; depinde de doza utilizată?; care este raportul beneficiu/risc?; care pacienţi sunt mai predispuşi la dezvoltarea diabetului zaharat?; care sunt mecanismele de dezvoltare a diabetului?; sunt necesare sau elaborate strategii de prevenţie a diabetului la tratamentul cu statine?; este necesară modificarea tacticii de utilizare a statinelor la dezvoltarea diabetului?
Mecanismele efectului diabetogen
Mecanismul molecular al dezvoltării diabetului zaharat (DZ) de novo indus de statine este complex. Au fost postulate mai multe mecanisme fiziopatologice care în cele din urmă se reduc fie la scăderea secreţiei de insulină, fie la reducerea sensibilităţii la hormon. Statinele ar putea produce hiperglicemie prin creşterea rezistenţei la insulină a muşchilor scheletici, a ţesutului adipos şi a ficatului. Ele pot afecta activitatea secretorie a celulelor beta pancreatice, căile de semnalizare a insulinei, sensibilitatea miocitelor/adipocitelor la insulină, funcţia mitocondrială a muşchilor scheletici şi toleranţa la efort. Mecanismele efectului diabetogen al statinelor se reduc la dezvoltarea insulinorezistenţei, disfuncţia celulelor beta pancreatice şi alterarea secreţiei de insulină realizate prin: inhibarea HMGCoA-reductazei; reglarea pozitivă a receptorului LDL; inflamaţia, oxidarea şi apoptoza celulelor beta; dereglarea biosintezei coenzimei Q10; inhibarea adiponectinei şi leptinei; alterarea transportatorilor de glucoză; blocarea canalului de calciu de tip L; inhibarea căilor de semnalizare a insulinei; modificarea dimensiunii particulelor de lipoproteine (figura 1)(2,13).
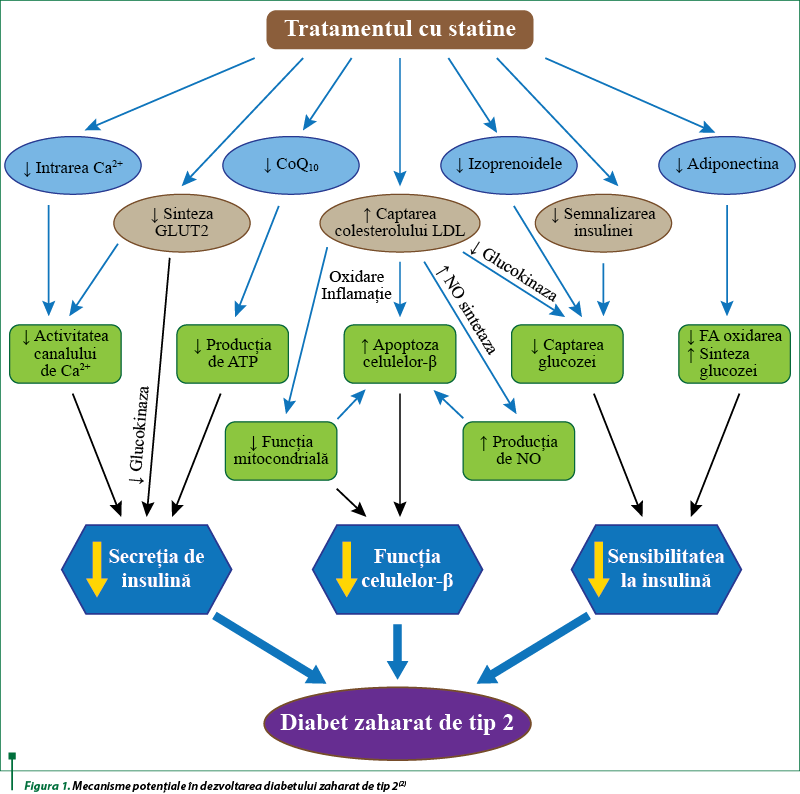
Efectul diabetogen al statinelor se explică prin mai multe mecanisme de acţiune coexistente: creşterea gluconeogenezei hepatocitelor prin suprareglarea exprimării genelor care codifică sinteza enzimelor; scăderea absorbţiei glucozei în ţesuturile periferice prin modificarea căii de semnalizare a insulinei şi reglarea negativă a GLUT4 odată cu dezvoltarea rezistenţei la insulină; reducerea producţiei de insulină din cauza leziunii celulelor beta insulare; acumularea de acizi graşi liberi în hepatocite; diminuarea producţiei de adiponectină şi leptină de către ţesutul adipos; alterarea profilului de expresie al microARN-urilor implicate în reglarea metabolismului glucozei şi a metabolismului lipidic; inducerea rezistenţei la insulină(7).
S-a postulat că creşterea nivelului glucozei în sânge poate fi determinată de activitatea statinelor asupra HMG-CoA reductazei, în special asupra variantei genetice a genei HMGCR, care se poate asocia cu un risc crescut de DZ de tip 2. Reducerea activităţii HMGCR determină suprareglarea receptorului LDL, care determină creşterea eliminării colesterolului LDL pentru a înlocui concentraţia intracelulară. Geneza colesterolului derivat din plasmă poate fi diferită de cea a colesterolului sintetizat de novo. Colesterolul endogen este esenţial pentru activitatea normală a celulelor beta pancreatice. Concentraţia colesterolului poate modifica activitatea secretorie a celulelor beta prin modularea funcţiei canalelor de calciu, precum şi mobilizarea granulelor de insulină şi fuziunea cu membrana. Influxul de colesterol prin receptorul LDL afectează activitatea, proliferarea şi supravieţuirea celulelor beta, în timp ce efluxul său prin intermediul transportoarelor restabileşte activitatea biologică şi supravieţuirea. Concentraţia crescută de colesterol derivat din plasmă poate inhiba glucozokinaza, care interferează cu absorbţia normală a glucozei(2).
Studiile au arătat că tratamentul cu doze mari de atorvastatină timp de 10 săptămâni creşte rezistenţa la insulină şi secreţia de insulină. Creşterea rezistenţei la insulină s-a considerat primară, asociată cu tratamentul cu statine, iar creşterea secreţiei de insulină s-a considerat a fi secundară, pentru compensarea creşterii rezistenţei la insulină şi menţinerea homeostaziei glucozei pe termen scurt. Creşterea rezistenţei la insulină, raportată în unele studii privind terapia cu statine, a fost asociată cu majorări ale glicemiei à jeun şi cu dereglări ale testului oral de toleranţă la glucoză la indivizi nediabetici trataţi cu statine timp de 8-12 săptămâni. S-au observat creşteri proporţional mai mari ale rezistenţei la insulină la cei care au fost mai sensibili la insulină la momentul iniţial(1).
Au fost postulate mai multe mecanisme care stau la baza dereglărilor metabolismului glucozei de către statine şi, în primul rând, asupra sensibilităţii la insulină şi secreţiei celulelor beta. Simvastatina şi atorvastatina, într-un studiu observaţional pe mai mult de 8000 de bărbaţi, au determinat o creştere dependentă de doză a glicemiei, o scădere medie a sensibilităţii la insulină cu 24% şi o scădere a secreţiei de insulină cu 12%. Într-un studiu la paciente cu sindrom de ovar polichistic, tratamentul cu 20 mg de atorvastatină comparativ cu placebo, pe o perioadă de şase luni, a condus la o scădere a sensibilităţii la insulină, în pofida unei scăderi a proteinei C-reactive, markerul inflamator(5).
Potenţialele efecte nocive ale statinelor asupra funcţiei celulelor beta pot fi determinate de efectele afluxului crescut de colesterol din cauza inhibării sintezei intracelulare de colesterol mediată de HMG-CoA, de inhibarea sintezei ubichinonei (CoQ10), care duce la stres oxidativ mitocondrial şi la apoptoza celulelor beta. S-a raportat că statinele manifestă efecte antiinflamatorii, dar o ipoteză recentă postulează că, în anumite condiţii, statinele pot activa inflamazomul NLRP3 din macrofage sau adipocite în prezenţa endotoxinelor, cu dezvoltarea rezistenţei la insulină mediată de interleukina-1β. S-a estimat că microbiomul intestinal alterat, la pacienţii cu obezitate sau alte stări dismetabolice, ar putea furniza lipopolizaharidă (LPS), o endotoxină care poate media efectul proinflamator paradoxal al statinelor prin activarea inflamazomilor. În condiţii fiziologice, o scădere moderată a sensibilităţii la insulină ar trebui compensată prin creşterea secreţiei de insulină de către celulele beta. În concluzie, efectele directe sau indirecte ale statinelor asupra funcţiei celulelor beta pot juca un rol important în diabetogeneză, în special la persoanele cu risc crescut(5).
S-a sugerat că mecanismele celulare care ar putea explica creşterea secreţiei de insulină se pot datora expunerii celulelor beta pancreatice la niveluri crescute de LDL-C, cu perturbarea homeostaziei glucozei. La incubarea celulelor beta pancreatice umane şi de şoarece cu LDL-C, a scăzut secreţia de insulină stimulată de glucoză conducând la moartea celulelor. Tratamentul cu statine al insulelor pancreatice de şoarece in vitro a redus nivelul de colesterol intracelular şi a îmbunătăţit secreţia de insulină. Studiile in vivo la şoareci hrăniţi cu conţinut ridicat de grăsimi a sugerat că tratamentul cu atorvastatină păstrează funcţia celulelor beta, creşte proliferarea şi reduce stresul reticulului endoplasmatic (RE) şi apoptoza. Concomitent, tratamentul pe termen lung cu statine poate să afecteze negativ secreţia de insulină şi să reducă receptorii pentru HMGCoA în celulele beta, putând determina o scădere a masei celulelor beta şi a secreţiei de insulină. Statinele la persoanele cu grad de severitate mai mare a sindromului metabolic prezintă un risc mai mare de a dezvolta DZ de tip 2 de novo, din cauza rezistenţei mai mari la insulină şi a glicemiei mai mari. Persoanele cu mai multe elemente ale sindromului metabolic au avut o rezistenţă mai mare la insulină şi o secreţie mai mare de insulină decât cei cu mai puţine elemente ale sindromului metabolic. În cursul studiului după terapia cu statine, relativ scurtă, la persoanele cu sindrom metabolic a crescut secreţia de insulină, dar nu şi rezistenţa la insulină. La terapia pe termen lung cu statine, DZ de tip 2 poate surveni la persoanele cu sindrom metabolic care dezvoltă creşteri suplimentare ale rezistenţei la insulină (din cauza statinelor, a creşterii în greutate, a inactivităţii fizice) şi nu sunt în măsură să menţină creşterea secreţiei de insulină pentru a compensa rezistenţa la insulină(1).
S-a estimat că statinele, prin scăderea nivelului de colesterol, pot contribui la creşterea riscului de DZ, în timp ce nivelul ridicat al colesterolului în ser este asociat cu un risc redus de DZ. Studiul de screening al hipercolesterolemiei familiale (HF) a examinat genele care afectează transportul transmembranar mediat de receptorii LDL-colesterol şi a constatat că DZ a fost prezent la 2,93% dintre subiecţii fără HF şi doar la 1,75% dintre subiecţii cu HF. Prevalenţa a fost cu 1,49% mai mare în grupul non-HF, chiar şi după ajustarea pentru variabilele relevante. Creşterea LDL-C în HF variază în funcţie de defectul genetic. Pacienţii cu defecte genetice care blochează sinteza receptorului LDL au niveluri de LDL mai mari decât la pacienţii cu receptor LDL defect. Potrivit conceptului că LDL-C crescut „protejează” împotriva DZ, prevalenţa DZ a fost de 1,12% la pacienţii cu receptori LDL negativi, 1,44% la cei cu receptori LDL defecţi şi de 1,91% la cei cu defecte în apoB. Astfel de rezultate sugerează că nivelurile scăzute de colesterol sunt responsabile pentru creşterea riscului de DZ la terapia cu statine. O metaanaliză a datelor genetice din 43 de studii a demonstrat că două polimorfisme (rs17238484-G şi rs12916-T) cu o singură nucleotidă în gena HMG-CoA reductazei au redus nivelurile LDL-C cu 2,3 mg/dl şi au crescut riscul de DZ cu 2% şi, respectiv, 6%. Ambele gene au fost, de asemenea, asociate cu creşterea greutăţii corporale şi a circumferinţei taliei, iar gena rs17238484-G a fost asociată cu niveluri crescute de glucoză şi insulină. Modificările conţinutului de colesterol celular ar putea afecta secreţia de insulină prin perturbarea funcţiei canalului de calciu voltaj‑dependent în celulele beta pancreatice, reducând astfel fuziunea granulelor de insulină cu membrana celulară pentru exportul ulterior. Alternativ, statinele ar putea reduce sensibilitatea periferică la insulină sau metabolismul glucozei prin reducerea funcţiei mitocondriale a miocitelor sau prin afectarea altor aspecte ale metabolismului muscular. Statinele modifică activitatea grupului de gene FOXO, ale cărui ţinte includ gene implicate în oxidarea carbohidraţilor. Alte posibilităţi includ efecte dăunătoare asupra funcţiei mitocondriale a adipocitelor şi celulelor beta pancreatice şi exprimarea redusă a transportorului de glucoză (GLUT4) din adipocite care răspunde la insulină. Astfel, toate statinele par să producă o mică creştere a riscului relativ şi absolut de DZ de novo, dar acest risc este mult depăşit de beneficiul lor. Mecanismul de mediere pentru acest efect ar putea fi legat de reducerea LDL-C şi, prin urmare, ar putea apărea şi cu alţi agenţi puternici de scădere a lipidelor(4,18).
Oxidarea colesterolului derivat din plasmă poate duce la activarea răspunsului imun, care provoacă procese inflamatorii şi oxidative ce afectează în cele din urmă integritatea funcţională şi structurală a celulelor beta, interferând astfel cu metabolismul glucozei. Dovezile actuale sugerează, că statinele ar putea activa proteina inflamatorie NLRP3 din macrofage/adipocite în prezenţa endotoxinelor precum lipopolizaharidele (LPS), provocând rezistenţă la insulină mediată de IL-1β. În timpul stării dismetabolice, microbiomul intestinal poate fi alterat cu furnizarea de LPS care activează inflamazomii ce mediază efectele inflamatorii paradoxale ale statinelor. Astfel, capacitatea statinelor de a induce inflamaţia şi disfuncţia mitocondrială în muşchiul scheletic, celulele beta şi adipocite a fost asociată cu dezvoltarea rezistenţei la insulină şi a DZ. În celulele beta, mitocondriile sunt esenţiale pentru a cupla metabolismul glucozei cu exocitoza insulinei, iar disfuncţia lor poate provoca apoptoza şi moartea celulelor beta(2).
Trei mecanisme pentru efectul statinelor asupra sintezei şi biodisponibilităţii oxidului nitric (NO) au fost propuse: reglarea crescută a activităţii nitric oxid sintazei endoteliale (eNOS), exprimarea îmbunătăţită a eNOS şi stabilizarea ARNm a eNOS. Astfel, inflamaţia, oxidarea şi apoptoza, declanşate de afluxul de colesterol plasmatic din cauza deteriorării sintezei de novo a colesterolului de către statine, ar putea determina patogeneza DZ în timpul utilizării pe termen lung a acestor medicamente(2).
S-a sugerat că acţiunea diabetogenă a statinelor poate fi determinată de inhibarea biosintezei coenzimei Q10. Coenzima Q este o moleculă liposolubilă cu un lanţ lateral de 10 unităţi izoprenoide, modulată de HMGCoA-reductază în calea mevalonatului. Coenzima poate exista sub formă redusă (ubichinol) sau oxidată (ubichinonă), iar tranziţia dintre ele îi permite să funcţioneze ca purtător de electroni în lanţul respirator mitocondrial. Această moleculă este disponibilă în toate membranele celulare, sânge şi lipoproteine, dar e mai concentrată în inimă, rinichi, ficat şi muşchi, dat fiind necesarul mare de energie a acestora. Din punct de vedere biologic, funcţionează ca un transportator de energie în membranele mitocondriale şi extramitocondriale cu acceptarea de electroni şi transferarea către complexul citocromului, cu sinteza de ATP. Astfel, deficienţele sale pot afecta lanţul de transport de electroni cu blocarea producţiei de ATP şi reducerea secreţiei de insulină. Coenzima Q10 joacă un rol esenţial în sinteza transportorului de glucoză GLUT4, iar inhibarea acesteia ar putea determina o reducere a expresiei transportorului în adipocite şi o reducere a absorbţiei de glucoză. Coenzima Q10 manifestă activitate antioxidantă ce protejează membranele plasmatice şi lipoproteinele de deteriorarea oxidativă. S-a sugerat că deficienţa acestei molecule scade activitatea celulelor beta, afectând astfel metabolismul glucozei. Depleţia coenzimei Q10 provoacă inflamaţia miocitelor şi deteriorarea fibrelor, care ar putea fi un posibil mecanism fiziopatologic al statinelor pentru a induce miopatia şi rezistenţa la insulină în muşchii scheletici. La persoanele în vârstă, deficitul coenzimei Q10 a fost asociat cu stresul oxidativ şi cu disfuncţia mitocondrială în muşchiul scheletic, care accelerează inducerea rezistenţei periferice la insulină la utilizarea statinelor. Suplimentarea cu coenzima Q10 îmbunătăţeşte funcţia celulelor beta şi sensibilitatea la insulină şi păstrează funcţia mitocondrială. Mecanismele efectelor antidiabetice sau de sensibilizare la insulină ale coenzimei Q10 ar putea fi determinate de reglarea receptorului de insulină şi adiponectină, de stimularea căilor de semnalizare a insulinei şi de creşterea receptorului solubil pentru produsele finale de glicaţie avansată(2,13).
Au fost descoperite diferite adipocitokine (molecule derivate din adipocite) care pot afecta metabolismul glucozei şi pot duce la rezistenţă la insulină şi DZ. Aceste adipocitokine includ leptina, adiponectina, rezistina, visfatina, proteina-4 de legare a retinolului, interleukina-6 şi factorul de necroză tumorală α (TNF-α). Adiponectina şi leptina erau cunoscute pentru activitatea lor de mediere a diabetogenităţii statinelor. Adiponectina măreşte şi imită acţiunile metabolice şi vasculare ale insulinei şi exercită efecte benefice asupra metabolismului carbohidraţilor. S-a raportat că adiponectina poate preveni dezvoltarea DZ prin îmbunătăţirea sensibilităţii la insulină datorită mai multor mecanisme: suprimarea gluconeogenezei; stimularea oxidării acizilor graşi în ficat; stimularea absorbţiei de glucoză; oxidarea acizilor graşi în muşchiul scheletic; stimularea expresiei genei insulinei şi secreţiei de insulină în celulele beta; îmbunătăţirea biogenezei mitocondriale şi oxidarea acizilor graşi în muşchiul scheletic. Concomitent, efectul antiinflamator al adiponectinei poate proteja funcţia şi viabilitatea celulelor beta, ceea ce îmbunătăţeşte sensibilitatea la insulină a ţesuturilor, în special a ficatului şi muşchilor. Nivelurile scăzute de adiponectină sunt puternic asociate cu factori genetici care ar putea contribui la creşterea riscului de DZ. Efectul inhibitor al statinelor asupra adiponectinei este un posibil mecanism pentru DZ de novo. Leptina, o altă proteină implicată în reglarea celulelor beta pancreatice, are un rol-cheie în reglarea masei celulelor beta. S-a raportat că rezistenţa la leptină şi/sau nivelurile reduse de leptină joacă un rol semnificativ în secreţia de insulină, rezistenţa la insulină şi în diabetul zaharat, prin efecte asupra secreţiei de insulină şi proliferării celulelor beta. S-a raportat reducerea nivelului de leptină la tratamentul cu rosuvastatină, simvastatină şi atorvastatină, cu influenţarea nedorită a proliferării celulelor beta şi a secreţiei de insulină, cu dezvoltarea DZ(2).
Studiile clinice au demonstrat că statinele pot deregla absorbţia glucozei de către diferite celule (miocite scheletice, adipocite) cu rol-cheie în reglarea metabolismului glucozei prin influenţarea proteinelor transportoare de glucoză, cu modificări conformaţionale dependente de colesterol în GLUT. Astfel, diminuarea colesterolului cauzată de statine perturbă construcţia proteinelor încorporate în membrană, inclusiv a transportorilor GLUT. În condiţii normale, glucoza difuzează în adipocitele pancreatice, în celulele musculare scheletice şi în celulele beta prin transportorii GLUT-2 şi GLUT-4 şi este cel mai vital semnal pentru secreţia de insulină. Transportorul de glucoză, în special GLUT-4, este responsabil pentru intrarea glucozei în celulele musculare scheletice şi adipocite. Statinele, prin împiedicarea expresiei genei transportatorului de glucoză, afectează metabolismul glucozei prin prevenirea absorbţiei acesteia în celulele beta pancreatice, celulele musculare scheletice şi celulele ţesutului adipos.
Expresia transportorului GLUT-4 în muşchiul scheletic scade odată cu vârsta, aceasta justificând efectul diabetogen mai pronunţat al statinelor la vârstnici. Tratamentul cu statine ar putea afecta transportorul GLUT-2, care transportă glucoza în celulele beta, care sub acţiunea glucokinazei este fosforilată în glucoză la glucoză-6-fosfat şi cu sinteza de ATP, indispensabilă pentru exocitoza granulelor şi secreţia de insulină. Statinele sunt capabile să inhibe expresia genică a canalului de calciu voltaj-dependent şi a GLUT-2, dereglând astfel secreţia şi sinteza insulinei. Inhibarea biosintezei colesterolului endogen de către statine, îndeosebi lipofile, poate bloca afluxul de Ca2+ mediat de tipul L, reducând astfel concentraţia citozolică a acestuia. Statinele lipofile au o afinitate mai mare pentru membrana celulară decât statinele hidrofile, pătrund cu uşurinţă în spaţiul intracelular şi inhibă căile metabolice endogene legate de secreţia de insulină indusă de glucoză(2,13,21).
Statinele blochează semnalizarea secreţiei de insulină provocată de glucoză şi de clorura de potasiu prin inhibarea sintezei mevalonatului. S-a postulat că terapia cu statine poate fi responsabilă de DZ prin scăderea transducţiei semnalului de insulină prin: modificarea răspândirii celulare a proteinelor G şi a proceselor esenţiale de fosforilare; perturbarea protein kinazei activate de mitogen şi fosforilării tirozinei a subunităţii beta a receptorului de insulină; reducerea expresiei şi fosforilării receptorului insulinic membranar; reprimarea diferiţilor factori intracelulari(2).
S-a observat că un polimorfism genetic care duce la o activitate redusă a HMG-CoA reductazei este asociat cu LDL-C mai scăzut, cu o creştere semnificativă a greutăţii corporale şi a rezistenţei la insulină. Această observaţie a fost validată în studiile randomizate cu statine şi o anumită alelă a fost asociată cu o creştere semnificativă a riscului de diabet. Deoarece statinele inhibă HMG-CoA reductaza ca mecanism de acţiune, acest lucru poate explica cel puţin parţial efectul lor diabetogen(5,21).
Implicaţiile clinice ale tendinţei statinelor de a predispune majoritatea pacienţilor către DZ de tip 2 sau chiar dezvoltarea DZ de novo la mulţi pacienţi cu factori de risc preexistenţi necesită elaborarea unor strategii de prevenţie. Deoarece raportul global risc-beneficiu rămâne puternic în favoarea terapiei cu statine ca prevenire a accidentelor vasculare de primă linie, chiar şi la pacienţii care mai târziu dezvoltă DZ de tip 2, abordarea optimă a utilizării statinelor necesită reducerea activă a riscului prin utilizarea măsurilor de atenuare. Recomandările privind dieta şi stilul de viaţă sunt în mod clar justificate, dar insuficiente şi impun luarea de măsuri de prevenire medicală. Pioglitazona ar trebui să fie în general prima alegere, deoarece este foarte eficientă în prevenirea DZ de tip 2, îmbunătăţeşte profilul lipidic şi reduce riscul de BCV. Concomitent, pioglitazona este ieftină, bine tolerată şi, în general, sigură, deşi este contraindicată la pacienţi cu insuficienţă cardiacă congestivă moderat-severă simptomatică. Suplimentarea metforminei la pioglitazonă poate îmbunătăţi prevenirea DZ de tip 2, iar metformina în monoterapie poate reduce, de asemenea, DZ de tip 2. Două statine utilizate mai rar, pravastatina sau, îndeosebi, pitavastatina, pot fi favorizate faţă de alte statine la pacienţii cu risc crescut de DZ de tip 2, datorită tendinţei lor aparent mai scăzute de a provoca diabet(3).
Concluzii
Statinele prezintă efecte benefice, atât prin optimizarea profilului lipidic, cât şi prin efecte pleiotrope multiple (antiinflamator, imunomodulator, antioxidant, antitrombotic etc.), cu rol în scăderea incidenţei evenimentelor cardiovasculare, a aterosclerozei şi a complicaţiilor diabetului zaharat.
Riscul de diabet zaharat în cazul terapiei cu statine este dependent de tipul statinei, de doză şi de durata tratamentului, precum şi în concordanţă cu capacitatea lor de inhibare a HMG-CoA reductazei.
Dovezile actuale nu recomandă evitarea utilizării diferitelor statine la persoanele cu risc cardiovascular ridicat, chiar dacă acestea pot induce dezvoltarea DZ de novo, deoarece beneficiile lor depăşesc riscurile.
La pacienţii care utilizează în mod sistematic statine, se recomandă investigarea consecventă a unor teste de laborator disponibile în mod obişnuit, precum testul oral de toleranţă la glucoză, glucoza à jeun şi hemoglobina glicată, împreună cu o urmărire regulată a factorilor de risc pentru diabetul zaharat.
Verigile patogenetice implicate în patogenia diabetului zaharat de tip 2 de novo la tratamentul cu statine se reduc la scăderea sensibilităţii la insulină (insulinorezistenţă) şi alterarea secreţiei de insulină, realizate printr-o gamă variată de mecanisme.
Mecanismele responsabile de dezvoltarea DZ de novo se reduc la: inhibarea HMGCoA-reductazei; reglarea pozitivă a receptorului LDL; inflamaţia, oxidarea şi apoptoza celulelor beta; dereglarea biosintezei coenzimei Q10; inhibarea adiponectinei şi leptinei; alterarea transportatorilor de glucoză; blocarea canalului de calciu de tip L; inhibarea căilor de semnalizare a insulinei; modificarea dimensiunii particulelor de lipoproteine.
La pacienţii cu risc crescut de DZ trebuie să se acorde o atenţie specială optimizării tratamentului hipocolesterolemiant prin selectarea statinelor adecvate, a dozelor şi controlul markerilor glicemici de bază, precum şi prin luarea în considerare a diferiţilor factori care afectează răspunsul diabetogen al terapiei cu statine, identificând persoanele mai vulnerabile.
La selectarea statinei pentru gestionarea dislipidemiei la pacienţii cu prediabet sau cu DZ, ar trebui luate în considerare particularităţile metabolismului carbohidraţilor la pacient, caracteristicile pacientului şi tratamentul dislipidemiei.
Pentru oferirea unei protecţii împotriva bolilor cardiovasculare, cu evitarea DZ de novo, se recomandă a începe tratamentului cu doze mici, prescrierea numai după indicaţii stricte, selectarea individuală a statinei, modificări ale stilului de viaţă, informarea pacientului despre risc, screeningul pacienţilor, alături de monitorizarea şi suplimentarea cu vitamina D (deficitul de vitamina D a fost asociat cu rezistenţa la insulină). Tratamentul cu statine rămâne de elecţie pentru prevenirea bolilor cardiovasculare, în pofida riscului de DZ de novo, care este încă în curs de caracterizare, şi care pare să fie semnificativ depăşit de scăderile considerabile ale mortalităţii prin BCV.
La dezvoltarea DZ se recomandă trecerea la o statină mai avantajoasă (pitavastastină, atorvastatină etc.), reducerea dozei de preparat şi administrarea de statine în zile alternative, iar în cazul reducerii controlului colesterolului la modificarea regimului cu statine va necesita administrarea dozei anterioare de statine şi includerea în tratament a unor medicamente antidiabetice.
Bibliografie
- Abbasi F, Lamendola C, Harris CS, Harris V, Tsai MS, Tripathi P, Abbas F, Reaven GM, Reaven PD, Snyder MP, Kim SH, Knowles JW. Statins Are Associated With Increased Insulin Resistance and Secretion. Arterioscler Thromb Vasc Biol. 2021 Nov;41(11):2786-2797. doi: 10.1161/ATVBAHA.121.316159.
- Alehegn AA, Kifle ZD, Abdulkadir M. Possible Diabetogenic Effects of Statins Therapy and its Clinical Implications. J Clin Exp Pharmacol. 2020; (10) 35248/2161-1459.21.10.27.
- Brinton EA. Statin-Related New-Onset Diabetes Appears Driven by Increased Insulin Resistance: Are There Clinical Implications? Arterioscler Thromb Vasc Biol. 2021 Nov;41(11):2798-2801. doi: 10.1161/ATVBAHA.121.316893.
- Ellulu MS, Samouda H. Clinical and biological risk factors associated with inflammation in patients with type 2 diabetes mellitus. BMC Endocr Disord. 2022 Jan 6;22(1):16. doi: 10.1186/s12902-021-00925-0.
- Ganda OP. Statin-induced diabetes: incidence, mechanisms, and implications. F1000Res. 2016 Jun 24;5:F1000 Faculty Rev-1499. doi: 10.12688/f1000research.8629.1.
- Gao L, Zhang Y, Wang X, Dong H. Association of apolipoproteins A1 and B with type 2 diabetes and fasting blood glucose: a cross-sectional study. BMC Endocr Disord. 2021 Apr 1;21(1):59. doi: 10.1186/s12902-021-00726-5.
- García-Fernández-Bravo I, Torres-Do-Rego A, López-Farré A, Galeano-Valle F, Demelo-Rodriguez P, Alvarez-Sala-Walther LA. Undertreatment or Overtreatment With Statins: Where Are We? Front Cardiovasc Med. 2022 Apr 29;9:808712.
- Galicia-Garcia U, Jebari S, Larrea-Sebal A, Uribe KB, Siddiqi H, Ostolaza H, Benito-Vicente A, Martín C. Statin Treatment-Induced Development of Type 2 Diabetes: From Clinical Evidence to Mechanistic Insights. Int J Mol Sci. 2020 Jul 2;21(13):4725. doi: 10.3390/ijms21134725.
- Grunwald SA, Haafke S, Grieben U, Kassner U, Steinhagen-Thiessen E, Spuler S. Statins Aggravate the Risk of Insulin Resistance in Human Muscle. Int J Mol Sci. 2022 Feb 21;23(4):2398. doi: 10.3390/ijms23042398.
- Habte ML, Melka DS, Degef M, Menon MKC, Yifter H, Feyisa TO. Comparison of Lipid Profile, Liver Enzymes, Creatine Kinase and Lactate Dehydrogenase Among Type II Diabetes Mellitus Patients on Statin Therapy. Diabetes Metab Syndr Obes. 2020 Mar 18;13:763-773. doi: 10.2147/DMSO.S234382.
- Jialal I, Singh G. Management of diabetic dyslipidemia: An update. World J Diabetes. 2019 May 15;10(5):280-290. doi: 10.4239/wjd.v10.i5.280. PMID: 31139315.
- Kim SJ, Kwon OD, Kim KS. Prevalence, awareness, treatment, and control of dyslipidemia among diabetes mellitus patients and predictors of optimal dyslipidemia control: results from the Korea National Health and Nutrition Examination Survey. Lipids Health Dis. 2021 Mar 26;20(1):29. doi: 10.1186/s12944-021-01455-3.
- Liu WT, Lin C, Tsai MC, Cheng CC, Chen SJ, Liou JT, Lin WS, Cheng SM, Lin CS, Tsao TP. Effects of Pitavastatin, Atorvastatin, and Rosuvastatin on the Risk of New-Onset Diabetes Mellitus: A Single-Center Cohort Study. Biomedicines. 2020 Nov 13;8(11):499. doi: 10.3390/biomedicines8110499.
- Mashayekhi-Sardoo H, Atkin SL, Montecucco F, Sahebkar A. Potential Alteration of Statin-Related Pharmacological Features in Diabetes Mellitus. Biomed Res Int. 2021 Mar 26;2021:6698743. doi: 10.1155/2021/6698743.
- Ormazabal V, Nair S, Elfeky O, Aguayo C, Salomon C, Zuñiga FA. Association between insulin resistance and the development of cardiovascular disease. Cardiovasc Diabetol. 2018 Aug 31;17(1):122. doi: 10.1186/s12933-018-0762-4.
- Ostrowska M, Adamski P, Koziński M, Navarese E, Kubica J. Diabetogenic effect of statins: a comprehensive review on the clinical relevance, underlying pathomechanisms and rationale for tailored statin therapy. Folia Medica Copernicana. 2015;3(4):145-153. 10.5603/FMC.2015.0009.
- Paseban M, Butler AE, Sahebkar A. Mechanisms of statin-induced new-onset diabetes. J Cell Physiol. 2019 Aug;234(8):12551-12561. doi: 10.1002/jcp.28123.
- Thompson PD, Panza G, Zaleski A, Taylor B. Statin-Associated Side Effects. J Am Coll Cardiol. 2016 May 24;67(20):2395-2410. doi: 10.1016/j.jacc.2016.02.071.
- Yoon JS, Lee HW. Diabetogenic effect of statins: a double-edged sword? Diabetes Metab J. 2013 Dec;37(6):415-22. doi: 10.4093/dmj.2013.37.6.415. PMID: 24404512.
- Yu Q, Chen Y, Xu CB. Statins and New-Onset Diabetes Mellitus: LDL Receptor May Provide a Key Link. Front Pharmacol. 2017 Jun 13;8:372. doi: 10.3389/fphar.2017.00372.
- Ward NC, Watts GF, Eckel RH. Statin Toxicity. Circ Res. 2019 Jan 18;124(2):328-350. doi: 10.1161/CIRCRESAHA.118.312782.
- Vergès B. Pathophysiology of diabetic dyslipidaemia: where are we? Diabetologia. 2015 May;58(5):886-99. doi: 10.1007/s00125-015-3525-8.
- Vijayaraghavan K. Treatment of dyslipidemia in patients with type 2 diabetes. Lipids Health Dis. 2010 Dec 20;9:144. doi: 10.1186/1476-511X-9-144. PMID: 21172030; PMCID: PMC3022752.
Articole din ediţiile anterioare
Terapia genică – modalitate terapeutică de mare actualitate
Terapia personalizată și prescrierea de medicamente inovatoare sunt prezențe constante în obiectivele de cercetare ale multora dintre disciplinele ...
Statinele şi efectul diabetogen (I)
Statinele constituie medicaţia de primă linie în profilaxia primară şi secundară a accidentelor cardiovasculare la pacienţii cu hipercolesterolemie...
Rolul farmacistului în managementul farmacoterapeutic al diabetului zaharat
Diabetul zaharat este o boală cronică din ce în ce mai frecventă, cu complicații generatoare de morbiditate și mortalitate semnificative. Diabetul ...
Preparatele antidiabetice la pacienţii cu diabet zaharat de tip 2 şi COVID-19
Conduita pacienţilor cu diabet zaharat în timpul pandemiei de COVID-19 evoluează odată cu revizuirea informaţiilor din studiile clinice randomizate...